専門獣医師が解説するエキゾチックアニマルの画像検査(エキゾ診療獣医学なら必ず読んで)
目次
背景
臨床の現場において、エキゾチックアニマルの画像診断は有用な診断アイテムの一つとなっていますが、検査装置の選択や検査方法は確立したものがなく、そして診断基準も定まったものがありません。具体的には、『マウスやハムスターなどの小型種の適切なレントゲン画像を撮るにはどの装置がよい?』『鳥やシマリスの検査の保定はどうするの?』『トカゲやヘビの画像診断基準はあるの?』『アルマジロなどの珍獣って画像診断できるの?』(写真1)などの声が聞かれるますが、漠然としたことは語られているものの、的確なことはどの書持にも記載されていません。

写真1:ミツオビアルマジロ:検査方法も診断基準もまったくデータがなく、経験的に検査・診断するしかありません。
従来の画像診断はX線と超音波検査が主流でしたが、近年はCTやMRIによるスキャン検査も、エキゾチックアニマルにおいても行われ、不可欠な診断方法の1つになりつつあります(写真2)〔Silverman 1993,Grosso 2019,Capello et al.2011〕。
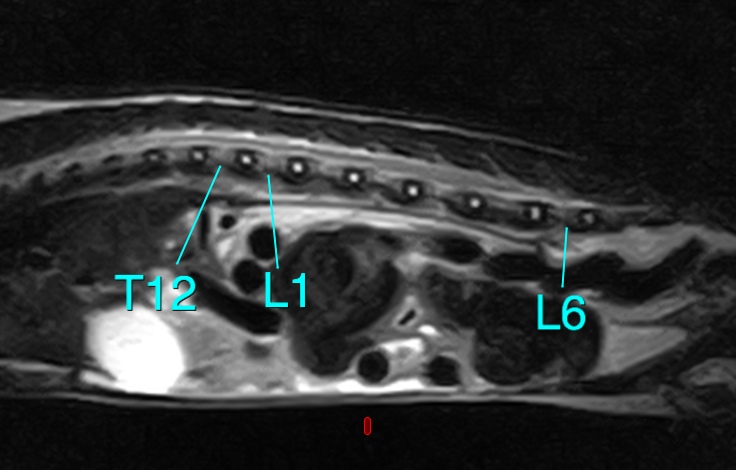
写真2:モルモットの脊椎のMR画像:全身麻酔での検査になりますが、適切な装置で検査を行えば診断に導けます。
マウスやラットのような実験動物では専用の画像診断装置が一部で販売されていますが、ペットの動物での使用や購入において現実的でない製品がほとんどです。
1.画像診断の位置付け
エキゾチックアニマルは小型種や保定が難しい種類が多く、犬や猫のような詳細な身体検査ができずに、無麻酔では血液検査も行えないこともあります。積極的な身体検査や血液検査を行うには、鎮静や麻酔が必要となるため、診察を進める上で画像検査に頼らざるをえないケースが多いです。可能であれば鎮静や無麻酔で行える画像診断にこだわりたいですが、適切な画像データを得るためには、やはり鎮静や麻酔が必要になるかもしれません。しかし、一般状態や呼吸状態が悪い動物には無理な保定によりチアノーゼや死亡させるような事故も多く、無麻酔や麻酔にせよ、検査の前に十分な状態の確認が重要です(写真3)。

写真3:状態の悪いブンチョウ:膨羽ならびに開口呼吸をしており、保定することさえも危険な状態です。
2検査保定
エキゾチックアニマルの鎮静や麻酔以外の保定では、適切なポジショニングをとることが難しく(写真4)、犬や猫のように上手くはいかないきません。動物への骨折やチアノーゼを起こすような負担または保定者をかんだり、引っかいたりするなどの攻撃により、怪我を負うことも避けなければなりません。

写真4:ユツユビハリネズミのX線撮影:防衛姿勢で丸まってしまうため、無麻酔で撮影するのは衰弱した個体でないと難しくなります。
犬や猫と同じ方法で検査保定をするにせよ、小型種のX線撮影においては、保定者の手や指が動物と共に撮影されることが多いです。防護手袋を使っての保定では、サイズが小さい動物やかんでくる動物では、四肢を上手く牽引できません(写真5)。各動物種毎に検査保定のコツを把握しないといけません。
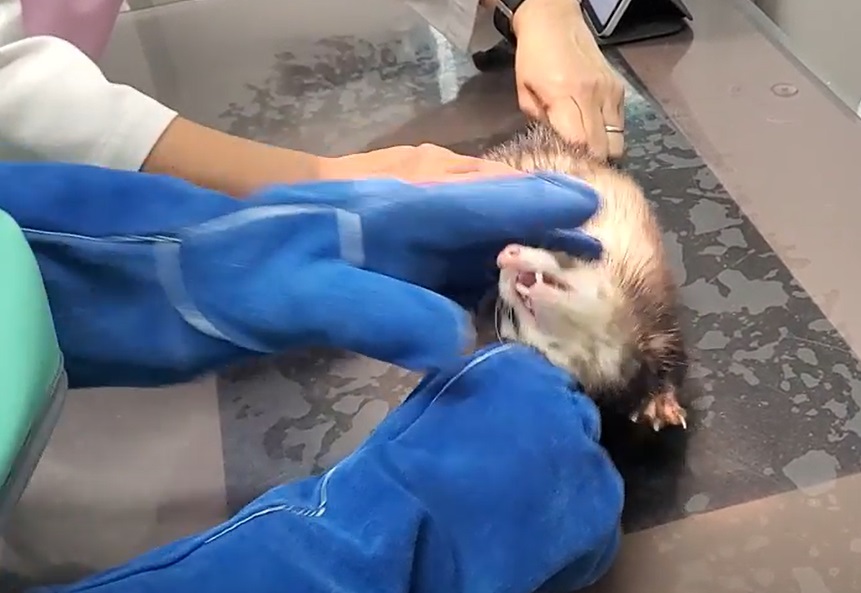
写真5:フェレットのX線撮影:ただでさえ抑えるのが難しい上に、噛みつくような性格では撮影が難しくなります。
3検査機器
実験動物ではなくペットのエキゾチックアニマルの検査で使用する、X線、超音波、CT、MRI装置について解説します。機器は基本的に犬や猫と同じ製品であるが、どのような性能が必要なのか、そして機械の設定などにもこだわって操作することが、検査保定とともに適切な画像を選るのに最低必要な要因となります。
3-1:X線
エキゾチックアニマルの身体のサイズはフィンチなどの小鳥から、硬い甲羅を備えた大型のリクガメまで幅広いです。犬や猫以上に身体の大きさや構造に相違があるため、一概に最適なX線発生装置は明言できません(写真6)。

写真6:ツノガエルのX線検査:カエルであっても、犬や猫用のX線発生装置で撮影するしかありません。
撮影条件
X線写真は白色~黒色の濃淡で表されますが、この濃淡差の違いはX線の管電圧と管電流、撮影時間で決定される。これら3つの条件を調整することが、エキゾチックアニマルの撮影日常業では重要になります。ウサギやフェレットなどの大きさ~セキセイインコやハムスターなどのサイズの動物種では、管電流(mA)が高く(200mAまたは300mA)、撮影時間が0.025~0.017秒〔Silverman et al.2006〕と短い時間で撮影します。あるいはmAsとして5.0~7.5mAsが推奨されています〔Silverman et al.2006〕。高い管電流により高解像度を、そして撮影時間を短くする組み合わせで細部の識別が有用になります。特に短い撮影時間は、動物の動き(モーションブラー/モーションアーチファクト)によって引き起こされるブレを最小限に抑えることもできます〔Wolvekamp 2004〕。動物は息を止めて撮影することもできず、さらに呼吸数が多い鳥類では撮影時間が短くないといけません。ウサギやフェレットなどのサイズでは、管電圧は約50kvP前後で行われ、対象となる厚さによって調整されます(写真7)。

写真7:管電圧の調整:基本的にエキゾチックアニマルではmAsを固定にして、管電圧を増減するとよいです。
マウスやフィンチなどの、さらに小さいサイズの動物では、管電圧は低く設定するべきです。なお、動物種だけでなく、個別に肥満や削痩、さらには甲羅や鱗の硬度などによっても管電圧は微増微減し、体幹が扁平なトカゲやドーム状の甲羅のカメなどでは、肺あるいは内臓領域を観察したいのかで、目的をもって調節しなければなりません(写真8)。エキゾチックアニマルでは、犬や猫よりも高い管電圧は不要で、kVpの小さな増分変更を行う機能を備えている必要があります。しかし、ミニブタなどの大型な動物も人気が出てきており、体幹は大型犬と同じあるいはそれ以上のこともあるので、高い管電圧が発生する高スペックの発生装置が必要です。各施設のX線発生装置やフィルムの種類などで画像は異なりますが、大まかな各動物種のX線撮影条件を列記してみたので参考にして下さ(表1)。

写真8:ヒョウモンガメの甲羅:甲羅が3次元的にドーム状をしているため、背腹方向にせよラテラル方向にせよ、体厚差があるので条件設定が難しくなります。
X線発生装置とフィルム間を90~100cmの距離で撮影します。出力が200mA未満の装置の場合、X線出力の減少を補うために、距離を短くする必要があるかもしれません。
表1:各動物種のX線撮影条件
| 動物種(体重) | 撮影部位 | mAs | mA | kVP | 引用文献 | |
| 哺乳類 | マウス(30g) | 全身 | 7.5 | 48 | Silverman et al.2006 | |
| 頭部 | 7.5 | 49 | ||||
| マウス、スナネズミ、ハムスター | 全身 | 300 | 42-46 | |||
| ハムスター(150g) | 全身 | 6.0 | 54 | Silverman et al.2006 | ||
| 頭部 | 7.5 | 52 | ||||
| ラット(300g) | 全身 | 6.0 | 52 | |||
| 頭部 | 6.0 | 52-53 | ||||
| チンチラ(500g) | 全身 | 5.0 | 44 | |||
| 頭部 | 6.0 | 54-56 | ||||
| 四肢 | 6.0 | 48-52 | ||||
| モルモット(1.2kg) | 全身 | 5.0 | 44 | |||
| 頭部 | 7.5 | 54 | ||||
| 四肢 | 6.0 | 48-52 | ||||
| フェレット(1.2kg) | 全身 | 5.0 | 44 | |||
| 頭部 | 6.0 | 54 | ||||
| 四肢 | 6.0 | 48-52 | ||||
| ウサギ(1.2kg) | 全身 | 5.0 | 44 | |||
| 頭部 | 7.5 | 54 | ||||
| 四肢 | 6.0 | 48-52 | ||||
| ラット、小型ウサギ、フェレット | 300 | 46-52 | Veterian Key.2006 | |||
| ウサギ(2.2kg) | 全身 | 5.0 | 46-48 | Silverman et al.2006 | ||
| 頭部 | 6.0 | 56-58 | ||||
| 四肢 | 6.0-7.5 | 52-54 | ||||
| 胸部 | 5.0 | 46 | ||||
| 脊椎 | 7.5 | 48 | ||||
| 骨盤 | 7.5 | 48 | ||||
| ウサギ(4.0kg) | 全身 | 5.0 | 46-48 | |||
| 頭部 | 6.0 | 56-58 | ||||
| 四肢 | 6.0-7.5 | 52-54 | ||||
| 胸部 | 5.0 | 46 | ||||
| 脊椎 | 7.5 | 48 | ||||
| 骨盤 | 7.5 | 46 | ||||
| ウサギ、モルモット | 全身 | 300 | 54-50 | Veterian Key.2006 | ||
| 鳥類 | フィンチ | 全身 | 300 | 42 | ||
| カナリア | 全身 | 300 | 44 | |||
| セキセイインコ | 全身 | 300 | 46‐50 | |||
| オカメインコ | 全身 | 300 | 50‐55 | |||
| 中型~大型オウム | 全身 | 300 | 55‐65 | |||
| 小型猛禽類(チョウゲンボウ、コキンメフクロウ、アメリカオオコノハズクなど) | 全身 | 300 | 50‐65 | |||
| 中型猛禽類(アメリカフクロウ、アカノスリ、アメリカワシミミズクなど) | 全身 | 300 | 55‐65 | |||
| 大型猛禽類(ワシなど) | 全身 | 300 | 60‐65 | |||
| 爬虫類 | 小型ヘビ(コーンスネークなど) | 全身 | 300 | 40‐44 | ||
| 大型ヘビ(ボールパイソンなど) | 全身 | 300 | 45‐55 | |||
| 小型トカゲ(ヒョウモントカゲモドキなど) | 全身 | 300 | 40‐55 | 私信 | ||
| 中型トカゲ(フトアゴヒゲトカゲなど) | 全身 | 300 | 45‐55 | |||
| 大型トカゲ(グリーンイグアナなど) | 全身 | 300 | 50‐60 | |||
| 小型カメ(幼体のカメなど) | 全身 | 300 | 50‐55(頭尾方向では+5) | |||
| 中型カメ(アカミミガメ、ギリシャリクガメなど) | 全身 | 300 | 55‐60(頭尾方向では+5) | |||
| 大型カメ(ヒョウモンガメ、ケヅメリクガメなど) | 全身 | 300 | 65‐70(頭尾方向では+5~10) | |||
X線パネル
現在は、フィルムの代わりに高精細フィルムスクリーンシステムであるCR(Computed radiography:CR)装置が使用されるようになってきました。CR装置では、X線画像をイメージングプレートに記録し、別置する専用のスキャナで取り込んで画像処理し、デジタル画像として表示・保存をします。そして、撮影後に濃度調整機能や画像処理によって適切な画像が作成できるメリットが大きいです。1枚の画像の読み出しには1分くらいの時間を要し、専用の大きなスキャナが必要になります。しかし、CR装置を使用することで撮影条件の選択から解放された訳でなく、いくら画像処理を行おうが、適切な画像を得るためには、適正な条件で撮影することを忘れてはいけません。そして、大面積の半導体検出器を用いたフラットパネルディテクター(Flat Panel Detector:FPD)がDR(Digital Radiography)と呼ばれ、X線で光または電子を発生させる層とそれを検出する層をセットにし、X線撮影と同時に画像をデータに変換へしてコンピュータに取り込むことができます。これによって、X線撮影後わずか数秒で画像を示すことができるようになり、利便性が高くなりました。エキゾチックアニマルは長時間の保定に耐えられない種類も多く、DR装置は再撮影までの時間が短縮できる利点がとても大きく、さらに専用のスキャナも不要になります。エキゾチックアニマルで必要とされる短時間の保定で連続撮影に、DR装置は最適と言えます(写真9)。

写真9:DR装置:瞬時に撮影できるDR装置は、エキゾチックアニマルの撮影に適しています。
消化管造影
単純撮影では詳細が分からない胃腸うっ滞や異物の評価、あるいは腹腔内の詳細を判断する上で、消化器管にコントラストをつける目的で消化管造影X線検査を行います。造影剤として硫酸バリウムを経口投与して、経時的に食道、胃、腸の流れ具合も観察します(写真10)。しかし、 消化管穿孔の恐れ、あるいは予め胃腸切開の可能性が高い症例ではヨード系造影剤を使用します。逆行的に結腸から投与することもあります。
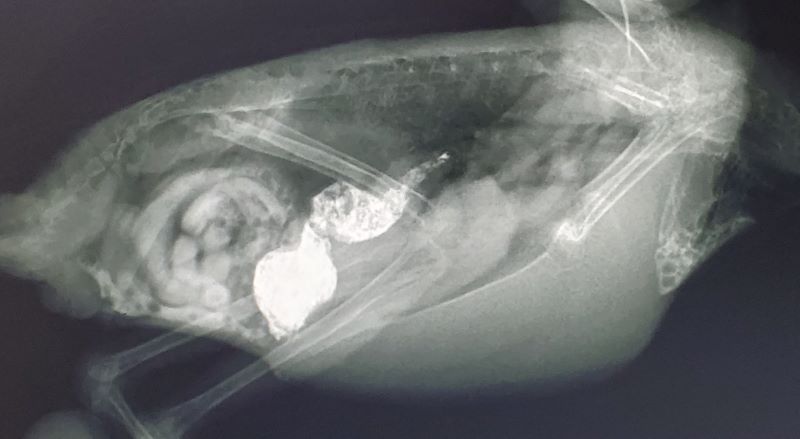
写真10:オカメインコの消化管造影X線検査:バリウムを飲ませ、経時的に流れ具合を見て適宜に撮影します。
尿路造影
静脈性尿路造影は血管確保ができる動物種に限られ、造影剤はヨード系造影剤を使用し、腎臓・尿管・膀胱をコントラストをつけて評価をします。特に腎臓を明瞭に映し出すために腹部の圧迫をバンテージなどで圧迫して巻くこともあります。尿道カテーテルが挿入できる動物種であれば逆行性尿路造影を行うこともできます。しかし、今日では尿路造影はあまり行われず、代わりに情報量が多く得られる造影CT検査で泌尿器系の評価は行われています。
3-2超音波
超音波は軟組織の画像診断には必須のアイテムです。リアルタイム画像を取得し、カラーおよびスペクトルドップラーを使用して血流を評価する機能を備えています。基本的に動物に振動を当てているだけであり、検査による身体的な負担や危険性はほとんどない非侵襲的検査ですが、ただし、鳥類など検査を行うための保定が負担になる種類もいます。一般的な超音波検査では、妊娠や卵胞の確認、卵巣・子宮の生殖周期のモニタリング、内臓の形状やサイズ、構造および均質性の評価、腹腔内腫瘤や胸腹水の確認、心エコー検査、およびTru-cutなどの侵襲的技術のガイドに使用されます。しかし、超音波では骨を画像化できないことと、超音波が空気中を伝わらないため、鳥の気嚢やウサギやモルモットなどの後腸発酵動物の腸ガスは、超音波を遮えぎってしまう欠点があります。また、皮下脂肪の量が多い動物だと、超音波は減衰します。
一般的にエキゾチックアニマルは犬や猫と比較して超音波画像を描出することが難しい種類が多い。甲羅や硬い鱗を持つ爬虫類では超音波を入射できる場所が制限されます。サイズが小さい動物では、プローブを密着して上手くあてれません、そして、サイズが小さい内臓の微細な構造に対しては、理論的にも高解像度な超音波装置が求められますが、一般に超音波画像は周波数が高いほど解像度が高くなり、小型のエキゾチックアニマルを対象とする場合は高スペックな製品が理想です。超音波診断で用いる周波数域は2~20MHz程度ですが、一般的に周波数が高いほど距離分解能が高いですが、減衰は逆に大きくなります。そのため、鮮明な画像を得られる高周波数プローブを使用すると、超音波の到達距離は短くなりますが、サイズが小さいマウスやハムスター、小型の鳥類では問題になりません。
超音波プローブも目的によって使い分けます(写真11)。コンベックス型は、主に体表からの腹部や臓器の検査時に使用するプローブで、接地面が大きく、扇状に広い視野(広角)の観察が可能となります。セクタ型は心臓エコー検査に使用するプローブで、接地面が小さく、扇状に広い視野(広角)の観察が可能となります。リニア型は体表血管に使用するプローブで、接地面が平で、視野幅を大きくとることが可能です。例えばハムスターの内臓を描出するには、接地表面付近の視野幅を大きくとれるリニア型プローブで検査することを推奨されます。リニア型は微細な異常を検出する血管診断や乳腺、甲状腺などの診断にも使用され、できれは10MHz以上の高周波数のプローブを使用するべきです。近年は1つのプローブで周波数を変えられる便利な機能もある。症例によっては経膣用プローブなどが使い易かったりもします。
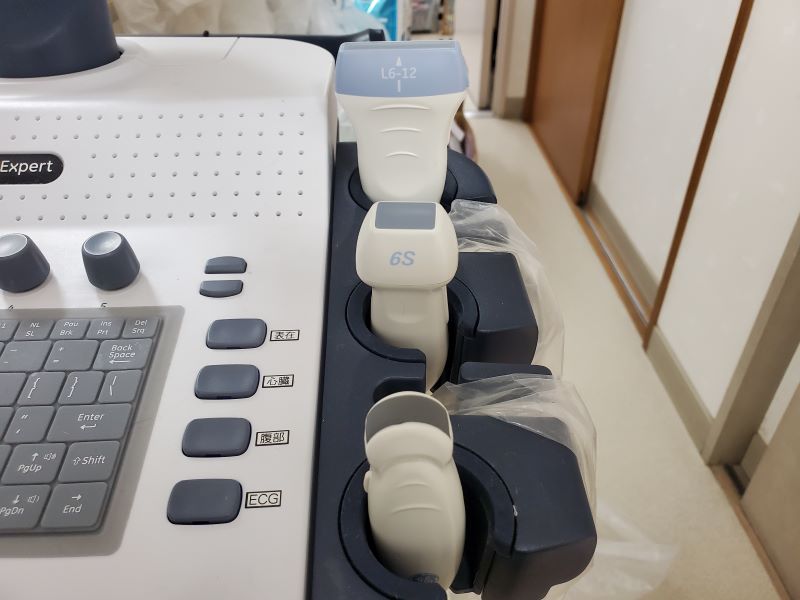
写真11:超音波プローブ:多種のプローブを用意しておくべきです。
超音波装置は、初期設定のままで検査を行っても問題ありませんが、装置の持つパフォーマンスを最大限に発揮する為にも調節は必須です。画像全体の輝度調整はGAIN、上下方向の細かい調整はTGC(Time-gain control)あるいはSTC(Sensitivity time control)で調整します。高周波数のリニア型プローブを使用するハムスターの検査では、深い部分が不明瞭になりがちなるため、深部のTGCを高くするとよいです(写真12)。

写真12:TGCの調整:高周波数のプローブ使用時に深部の不明瞭な領域を探る時に調整します。
Depthは表示する視野の深さで、臓器や腫瘤全体を描出する際に、深くまで調節します。ZOOMは部分的に拡大して観察する時に使用しますが、おそらくDepthで拡大するよりも画質が悪化します。臓器や腫瘤などが不明瞭に描出された際には、境界を明確させるためのDR(ダイナミックレンジ)を調整するとよいです。また、画像横に深度の目盛りのfocusのポイントがありますが、評価したい臓器の深さにポイントを合わせることでも画像は明瞭になります。各機種によっての調整機能は異なるので、使用する前に操作を把握しておくべきです(写真13)。

写真13:超音波装置の調整ボタン:メーカーや機種によって異なりますが、画像を明瞭にする調整を惜しまないようにして下さい。
超音波検査において、解像度が高い機器および調整をすることが重要であることは上述しましたが、検査時のプローブの押し加減もコツの一つになりまする。ただ押せば良いというものではなく、強く押すことで脂肪肝では亀裂が入ったり、腫瘍が潰れてしまうこともあります。ウサギやモルモットなどの大量の腸ガスは、プローブを優しくゆっくりと押すことで上手くガスを左右上下に退け、目的の臓器へのアプローチを可能にします(写真14)。
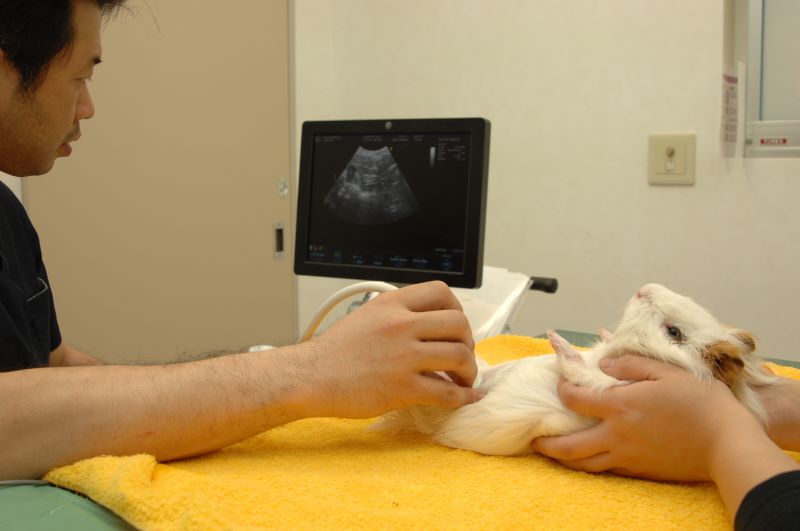
写真14:モルモットの腹部超音波検査:腹腔内にプロ-プをあてる際には、強すぎない力で行う。
心臓エコーあるいは内臓の測定評価において、サイズならびに機能を数値化できるのも超音波検査のメリットです。しかし、エキゾチックアニマルでは内臓はもちろん内部構造が犬や猫ほど明確に描出されないため、測定ポイントの設置もおおよそになり、測定値は絶対的に信用できるものではありません。例えば心臓エコー検査Mモードではエコーの反射信号が現れた所、すなわち手前を境界面として認識して計測するLeading edge法で行われますが、心不全が多発するウサギやハムスターでの心臓エコー検査では、全ての測定は内腔を計測するEndocardial-cavity interface法を使います(写真15A, B)。
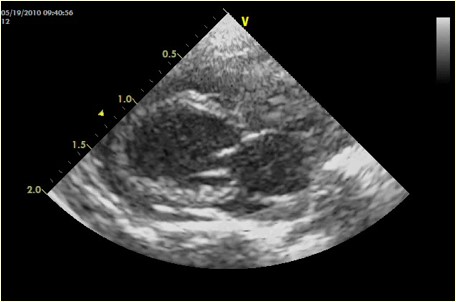
A:長軸像Bモード
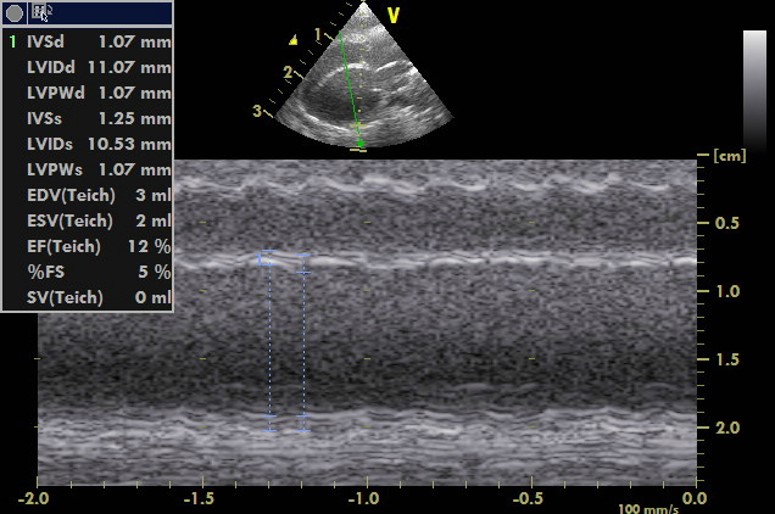
B:長軸像Mモード
写真15:ゴールデンハムスターの心エコー像:測定値は絶対的な数値ではなく、大まかな判断あるいは変動観察にします(A,B)。
長時間の保定が難しい動物種では、短時間に描出した画像を動画で保管でき、保管後に測定やカラードップラーにすることができる機能が備わっている装置が理想です。
超音波ゼリー
動物の体にプローブを当てる際に超音波ゼリーを使用します。超音波を効率よく体内へ透過するために生体の音響インピーダンスに近いゼリーをプローブに塗ることで、超音波が効率よく体に透過させます。ゼリーの成分は精製水、ポリマー、保湿剤、pH調整剤、防腐剤などで、エキゾチックアニマルでの問題点は、小型種ではゼリーの大量塗布による体温低下、経口摂取、被毛付着によるベタつきなどが起こります。ハムスターなどのげっ歯類ではゼリーを拭き取っても、濡れた被毛を気にして、しきりに舐め取る行動が見られます(写真16)。カエルなどの両生類は皮膚からの水分吸収を行うため、ゼリーの成分にも注意を払いたいです。
写真16:ゴールデンハムスターの超音波ゼリー舐め:体にゼリーが付着することを嫌がって舐めるため、検査後はよく拭き取るべきです。
人でもゼリーが冷たいことでの不快感もあり、超音波のゲルを体温程度に保温することができる超音波ゼリー加熱機を使用するとよい(写真17)。 不快な冷たい感じを取り除くだけでなく、弛緩を助け、同時に保温したゼリーは超音波画像の質を高める。

写真17:超音波ゼリー加熱機:ゼリー置き場が保温される装置です。
近年はゼリーを簡単に拭きとれて、ベタつかない機能性ゼリーも販売されている。銀系抗菌剤を配合したゼリーでは除菌も可能となっています。もちろんゼリー粘度も選ぶことができるため、液だれしにくく、プローブと患部を密着できれば、多様なエキゾチックアニマルにおいても使い分けることができると思います。特に爬虫類の鱗では、ゼリーが体になじめず、ゼリーの選択に悩みます(写真18)。

写真18:ヒョウモントカゲモドの超音波ゼリー塗布:細かい鱗間までゼリーを浸透させます。
3-3:CT検査とMRI検査
コンピューター断層撮影(CT:Computed Tomography)や磁気共鳴画像法(MRI:Magnetic Resonance Imaging)などの高度なスキャン検査は、現在エキゾチックアニマルでは行われているものの、十分に活用されているとはいえません。犬や猫と同様に、 X線や超音波検査で診断が得られない場合の次のステップの検査として認識されています。例えば プラスチック異物による胃腸閉塞などの症例では、X線では検出されずにCT検査で判断されます。また、中枢疾患などもある程度の身体の大きさの動物種であれば、MRI検査で診断できると思われがちですが、どこまで小さい脳が評価できるかは分かっていません。
3-3-1CT検査
CT装置を導入する動物病院施設は、ここ数年で増加しています。CT装置は動物の体に回転しながら360度方向からX線(放射線)を放射して、動的に取得された画像を得る検査で、様々な厚さのスライスとして連続断面画像にし、3D画像も作成することができます。従来のCTは検出器(X線管球から出された放射線を検出する装置)が1列のみであったが、 大きな臓器を短時間で撮影するために4列、8列、16列、32列、64列と検出器の列数が増えてきました。検出器の多列化した検出器のCT装置をマルチスライスCTと呼びます。マルチスライスCTのメリットは広い範囲を細かく早く撮影でき、時間分解能が向上し、従来のCTでは発見が困難だった小さな病変も発見することが可能となり、エキゾチックアニマルでのCT診断の有用性も向上してきました(写真19)。また、X線被爆線量も減少する点もメリットになります。
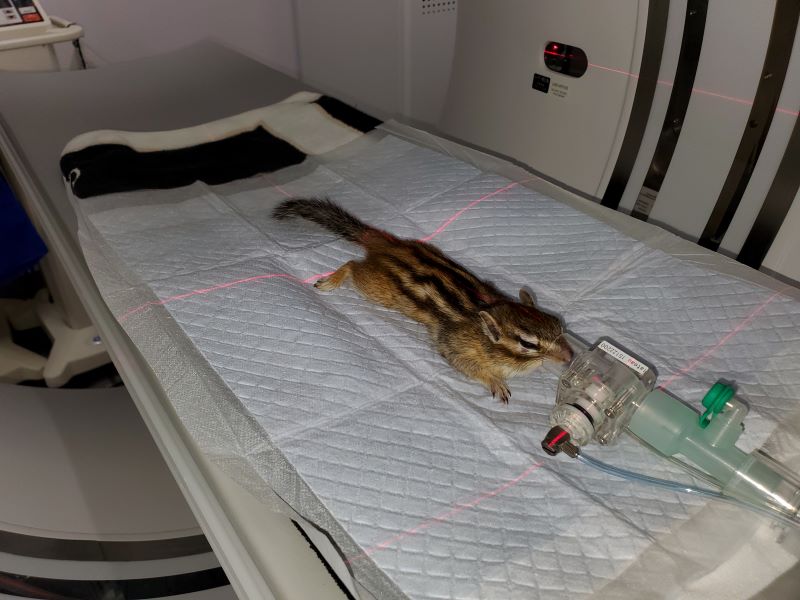
写真19シマリスのCT撮影:全身麻酔下で撮影する。
CT検査の最も有用なアプリケーションの1つは、ウサギ、モルモット、チンチラなどの歯牙疾患の診断です。従来のX線写真は2次元画像で、対象となる物が重なるため、歯と周囲骨との位置関係において有用な情報は得られませんでした。しかし、CT画像では、歯ならびに歯根および下顎や上顎などの周囲骨の構造の関与を、完全に評価できます。特にウサギでは固定箱に収納して無麻酔で撮影できることもあり、その有用性が高いです(写真20A,B)。

A:撮影箱への収容
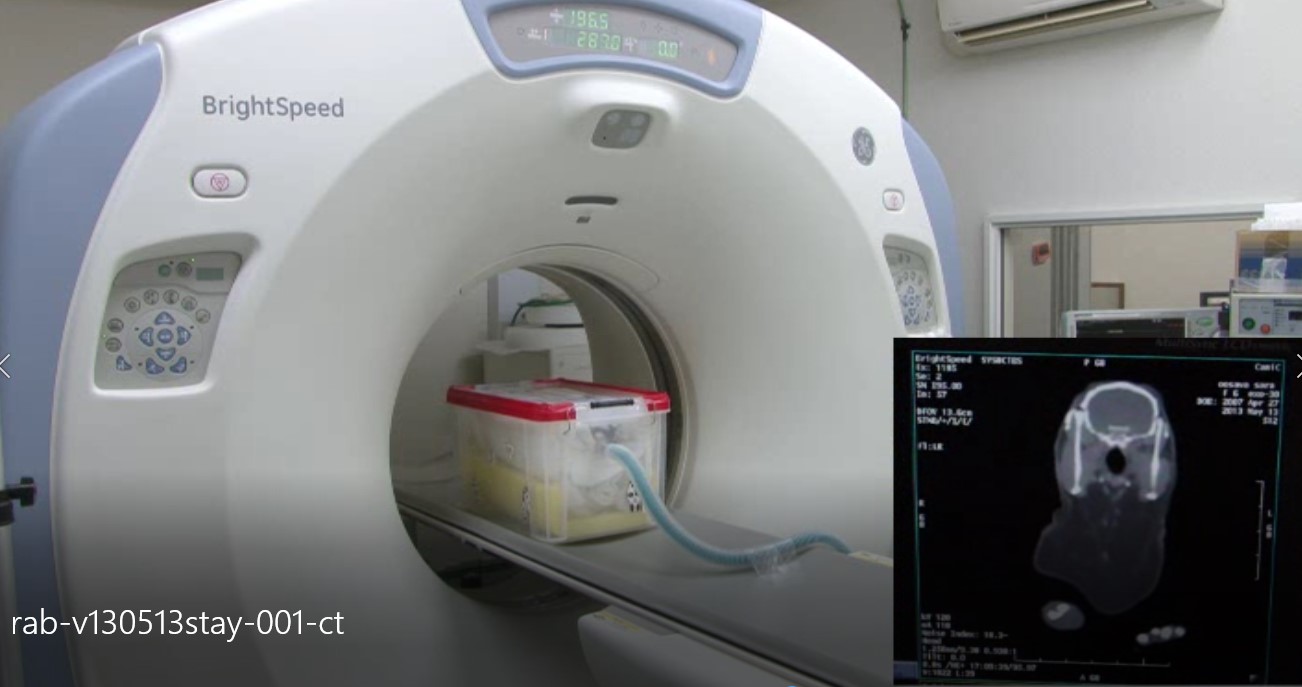
B:無麻酔撮影
写真20:ウサギのCT撮影:無麻酔の状態で、タオルを敷き詰めた撮影箱に収容して撮影しまする。
一般的にCTスキャンは全ての骨構造の優れた画像が得られ、1mm以下の厚さのスライスで検査ができるため、小さな骨折やひびは容易に診断できます。慢性上気道感染症(ウサギのスナッフルなど)による鼻甲介の軟骨溶解(写真21)、慢性中耳炎による鼓室包蓄膿の診断などにも有用です。つまり、CT検査は従来のX線写真では診断できない小さな変化を画像化するためのモダリティと言えます。ウサギなどでは健常体解剖臓像とCT像の比較も報告がなされ、臨床で十分に活用ができる報告もあります〔Van Caelenberg et al.2010〕。なお、近年流通しているマイクロCT装置では、骨と歯の微細構造が明瞭であるが、軟部組織のコントラストが比較的悪いです〔De Rycke et al.2012〕。
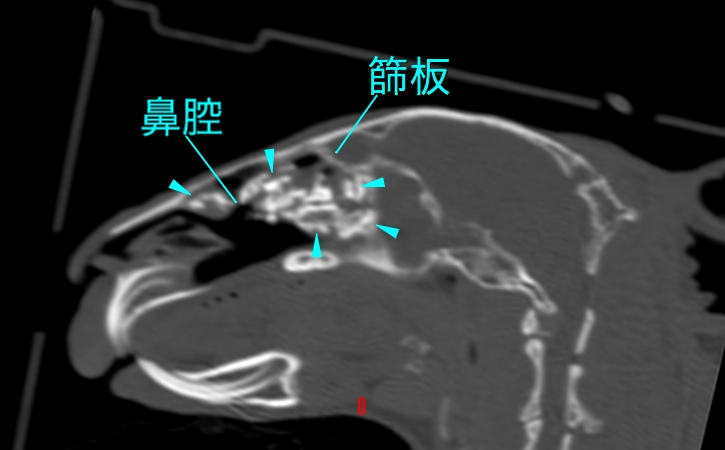
写真21:スナッフルのウサギデのCT像:鼻甲介の軟骨が融解し、石灰化亢進を起こしている(青矢印)。
爬虫類や鳥類でのCT検査も、臨床解剖とCT画像の比較などの報告が増えており、臨床的な検査として期待されています。ただし、爬虫類ではグリーンイグアナ、テグートカゲ、アゴヒゲトカゲ、ボアコンなどの中大型種〔Banzato et al.2011,Banzato et a 2012,Banzato et al.2013〕、鳥類でも、コンゴウインコ、ヨウム、オキナインコなどの中大型種〔Veladiano et al.2016〕では、かなり実用的と言え、特に爬虫類は無麻酔で撮影できる種類が多いので、多用するべき検査と思われます(写真22)。
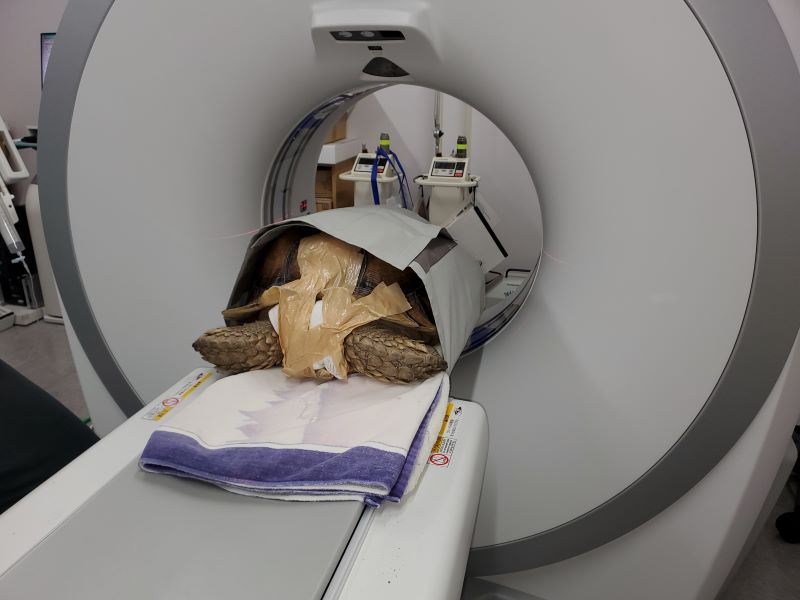
写真22:ケヅメリクガメのCT撮影:ガントリーに入るサイズなら撮影は可能である。
今後は、マルチスライドCTも進化することで、ハムスター、セキセイインコ、ヒョウモントカゲモドキ、ヘビ、カエルなどの小型な種類でも、更なる詳細な評価ができるようになるでしょう(写真23)。
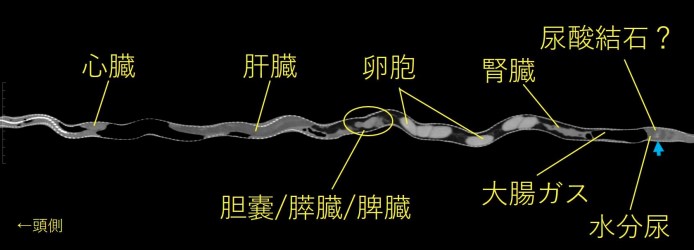
写真23:カラスヘビのCT像
3-3-2MRI検査
MRI検査は強力な磁場と電波を用いて、磁場の変化に反応した体内の水素原子の動きを画像化した検査です。原則としてCTが断層画像であることに対し、MRIは任意の断面が得られます。輪切り像(断面)だけでなく、身体の正面から縦に左右に分ける断面(矢状面)、身体の横から縦に前後に分ける断面(冠状面)など、様々な断面から診断できます。MRI検査は軟部組織の画像コントラストに優れ、頭部、脊髄、関節 など骨に囲まれた部位では最優先の検査になり、特に脳炎や脊髄疾患などの神経疾患において最適な画像診断モダリティとなります。ただし、MRIによる撮影では、CT撮影と比較して撮影時間が長くなるため、検査における麻酔は必須となり、一般状態の悪い動物には積極的に検査を推奨できません(写真24A,B)。また、MRI装置はCT装置よりも高額であるため、導入している動物病院施設は限りなく少ないです。
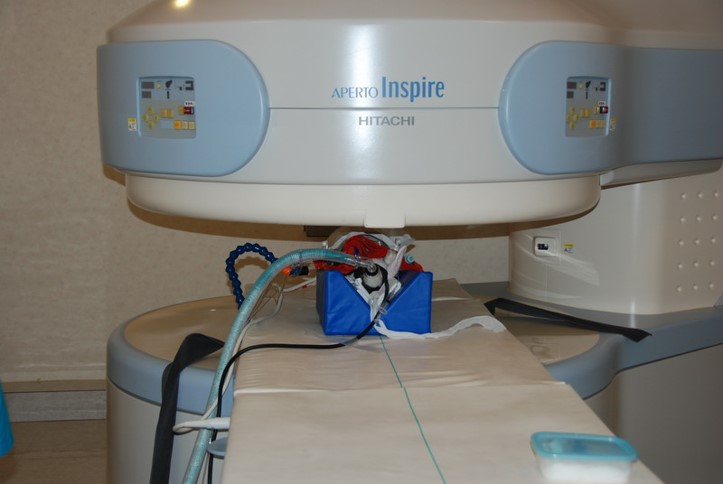
A永久磁石装置
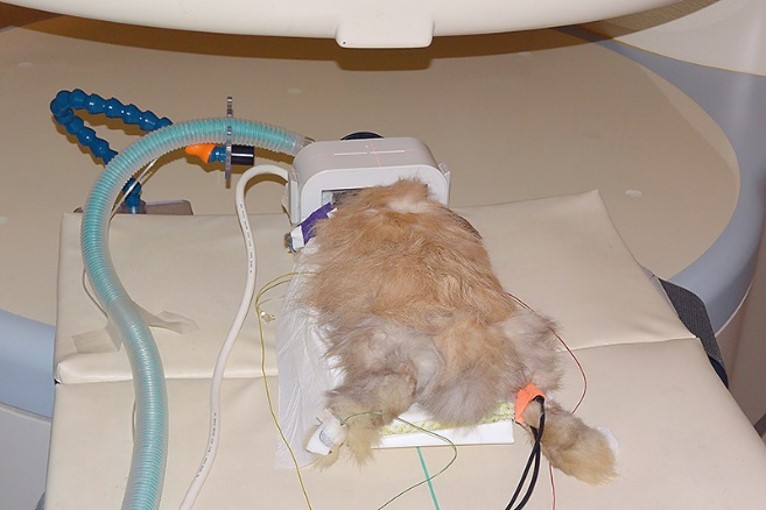
B麻酔下でのウサギの撮影
写真24:MRI撮影:全身麻酔下で行うことから、撮影中も循環や呼吸を監視しながら撮影します(A,B)。
実際の診療で使われている磁石は、0.5~3T(テスラ)の磁場強度が普及しており、磁場の強さだけではなく、その磁場の均一性も重要な要素となっています。磁石は永久磁石と超電導磁石が一般的に使用されている。常に磁場を持っている永久磁石よりも、電流が輪になった電線の中を通り、磁場を作りだしている超電導磁石の方が高磁場で(1.5~3T)、磁場の均一性も高く、エキゾチックアニマルの検査に適しています。ウサギやモルモットなどでは解剖像とMR像との比較がなされ〔Mahdy 2022〕、ウサギはCT像とMR像との比較がされたりと〔Skalec et al.2019〕、臨床的に使用できる検査に近づいています。なお、ウサギやフェレットなどの脳の評価には、永久磁場よりも3Tの高磁場のMRI装置で行うことが理想です(写真25A~C)。電界強度が大きいほど、信号対雑音比が大きくなり、より高い解像度の画像が得られるだけでなく、より高速な撮影時間が可能になり、麻酔時間も短くなります〔Désirée et al.2015〕。
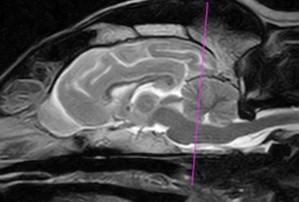
A:イヌ(ミニチュアダックス)
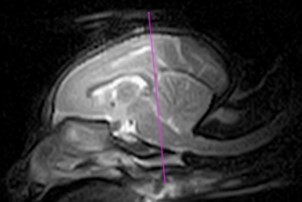
B:リスザル
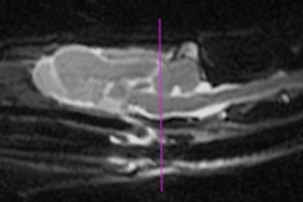
C:フェレット
写真25:永久磁場MR装置における各動物の脳のMR像:イヌは脳高4㎝前後で脳皺も明瞭ですが(A)、脳高2.8㎝のリスザル(B)、脳高1.3㎝のフェレット(C)では、脳の評価の信頼度は下がります。
モルモットでは7.5TのMRI装置で脳を〔Koizuka et al.1997〕、9.4Tの造影撮影で内耳を、それぞれ詳細に構造の評価が行われています〔Zhao et al.2020〕。さらに11.7Tの装置で心筋症のモルモットの左心室機能と壁厚までが正確に評価することが可能でした〔Saito et al.2017〕。MRIは軟組織に高いコントラストを与える特徴があるので、小型げっ歯類の内臓の評価にも、十分に応用できます。また、カメやトカゲでは、軟部組織と硬結な甲羅や鱗のコントラストが低いため、X線診断が限られ、超音波検査は、プローブをあてる箇所が一部であり、 CTよりも内臓の断層評価は有効です。ただし、残念ながら3T以上の高スペックのMR装置は、医学領域では臨床開発に至っていません。
3-2-3CT検査とMRI検査における造影撮影
CTやMRI検査では、それぞれ造影撮影もできます。CT造影検査ではヨード剤による静脈性造影撮影が行われ、造影により組織コントラストがついて見えやすくなり、血管分布も確認できるため、嚢胞性病変または固形病変を鑑別するのに役立ちます。腫瘍病巣においては固着具合の評価や肺転移などの診断も可能にし、静脈性造影検査では造影剤が腎臓を介した排泄を示すため、尿の生成機能ならびに尿路の詳細な確認もできます。なお、血管確保が難しい小型げっ歯類や鳥類、爬虫類などでは、造影撮影は不可になります。
ヨード剤の造影剤の副作用の頻度は、動向の状態や造影剤の種類によって異なりますが、人での発生率は3.13%、そのうち重篤なものは0.04~0.004%とされています〔片山 1999〕。副作用は、嘔気、嘔吐、かゆみ、蕁麻疹、血圧低下などの軽度のものが多く、重篤なものとしては、低血圧、呼吸困難などのアナフィラキシーです。副作用の発現の多くは5分以内と、投与直後に生じます〔片山 1999〕。また、腎機能低下していると副作用がみられる場合があるので注意して下さい。MRI検査の造影撮影ではガドリニウム製剤を使用します。副作用の頻度はヨード造影剤に比べて低く、同様に蕁麻疹、頭痛、悪心や嘔吐などです。CT造影撮影でのイオヘキソール(非イオン性ヨード系剤)と、MRI造影撮影でのガドブトロール(ガドリニウム系剤)を投与された犬の副作用の統計報告がありますが、両造影剤とも緊急治療を要するほど重度の副作用を引き起こす事は稀で(イオヘキソール0.8%、ガドブトロール0.2%)、脈拍、呼吸数、平均動脈血圧の軽度の異常は、イオヘキソールはガドブトロールの約2倍になることが報告されています〔Stefania et al.2016〕。エキゾチックアニマルにおいての副作用の発現について、詳細はまだ知られていませんが、十分に発生し得るために注意するべきです。
3-2-4マイクロチップの影響
CT検査ではマイクロチップを含む金属の周囲では画像が歪み、顕著な場合は読影困難となることがあります。フェレットや爬虫類ではマイクロチップが装置されている個体がいるため注意して下さい。
4画像読影ならびに診断
エキゾチックアニマルの画像診断では解剖学知識を熟知することが不可欠です。X線や超音波検査はもちろん、CTやMRI検査では各臓器のサイズ、形状、位置、描写、密度および均質性の評価などの評価を行わないといけません。各動物種の正常像を把握し、種得意的な構造を考慮に入れる必要があります。いくら画像診断の専門医でも、エキゾチックアニマルの解剖に熟知していないと臨床診断はできません(写真26)。

写真26:コリーマオオツノトカゲ:正常な解剖を知らないと異常の判断がつかないが、種類毎の解剖情報も皆無に近い動物が沢山います。
エキゾチックアニマル専門画像診断
株式会社EICでは、犬猫以外のエキゾチックアニマルのX線、超音波、CT、MRI画像の画像診断を行っている。犬や猫以外の画像診断を行い、症例によっては治療などの症例支援も行ってます。撮影を行ったが、読影ができない場合はEICに申し込むとよいであろう。

https://exo.co.jp/support/diagnostic_imaging.htm
謝辞
本原稿は、株式会社キャミックの小川藍先生に指導ならびに校正、写真作製を、富士フイルムVETシステムズ株式会社のMS・IOT推進グループマネージャー平子康夫氏に指導ならびに校正をして頂きました。この場を借りて厚く御礼を申し上げます。
参考文献
■Banzato T,Selleri P,Veladiano IA,Martin A,Zanetti E,Zotti A.Comparative evaluation of the cadaveric,radiographic and computed tomographic anatomy of the heads of green iguana (Iguana iguana),common tegu (Tupinambis merianae) and bearded dragon (Pogona vitticeps).BMC Vet Res11(8):53. 2012
■Banzato T,Seller P,Veladiano IA,Zotti A.Comparative evaluation of the cadaveric and computed tomographic features of the coelomic cavity in the green iguana (Iguana iguana), black and white tegu (Tupinambis merianae) and bearded dragon (Pogona vitticeps).Anat Histol Embryol42(6):453-60.2013
■Banzato T,Russo E,Toma AD,Palmisano G,Zott AI.Evaluation of radiographic, computed tomographic, and cadaveric anatomy of the head of boa constrictors.Am J Vet Res72(12):1592-1599.2011
■Capello V,Lennox AM.Diagnostic imaging of the respiratory system in exotic companion mammals.Vet Clin North Am Exot Anim Pract 14(2):369-389.2011
■De Rycke LM,Boone MN,Van Caelenberg AI,Dierick M,Van Hoorebeke L,van Bree H,Gielen IM.Micro-computed tomography of the head and dentition in cadavers of clinically normal rabbits.Am J Vet Res73(2):227-232.2012
■Désirée Müllhaupt,Heinz Augsburger,Andrea Schwarz, Gregor Fischer,Patrick Kircher, Jean-Michel Hatt,Stefanie Ohlerth.Magnetic resonance imaging anatomy of the rabbit brain at 3T.Acta Vet Scand57(1):47.2015
■Grosso FV.Orthopedic Diagnostic Imaging in Exotic Pets.Vet Clin North Am Exot Anim Pract22(2):149-173.2019
■Koizuka I et al.Micro-magnetic resonance imaging of the inner ear in the guinea pig.NMR Biomed;10(1):31-34.1997
■Mahdy MAA.Correlation between computed tomography, magnetic resonance imaging and cross-sectional anatomy of the head of the guinea pig (Cavia porcellus, Linnaeus 1758).Anat Histol Embryol51(1):51-61.2022
■Saito S et al.Longitudinal observations of progressive cardiac dysfunction in a cardiomyopathic animal model by self-gated cine imaging based on 11.7-T magnetic resonance imaging.Sci Rep22.7(1):9106.2017
■Skalec A,Janeczek M.High-field magnetic resonance imaging of a normal anatomy of the rabbit commoncalcanean tendon.Jun;22(2):431-433. 2019
■Stefania Scarabelli,Peter Cripps,Eva Rioja,Briony Alderson.Adverse reactions following administration of contrast media for diagnostic imaging in anaesthetized dogs and cats:a retrospective study.Veterinary Anaesthesia and Analgesia43(5).p502-510.2016
■Silverman S.Diagnostic imaging of exotic pets.Vet Clin North Am !Small Anim Pract23(6):1287-1299.1993
■Silverman S,Tell LA.げっ歯類・ウサギ・フェレットのX腺アトラス.三輪恭嗣訳.学窓社.東京.2006
■Van Caelenberg AI,De Rycke LM,Hermans K et al.Computed tomography and cross-sectional anatomy of the head in healthy rabbits.Am J Vet Res71(3):293-303.2010
■Veladiano IA,Banzato T,Bellini L,Montani A,Catania S,Zotti A.Computed tomographic anatomy of the heads of blue-and-gold macaws (Ara ararauna),African grey parrots (Psittacus erithacus),and monk parakeets (Myiopsitta monachus).Am J Vet Res77(12):1346-1356.2016
■Veladiano IA,Banzato T,Bellini L,Montani A,Catania S,Zott AI.Normal computed tomographic features and reference values for the coelomic cavity in pet parrots.BMC Vet Res5:12(1).182.2016
■Veterian Key.Avian and Exotic Radiography.Fastest Veterinary Medicine Insight Engine.https://www.dvm360.com/view/avian-radiography-and-disease-proceedings.2016
■Zhao D et al.In vivo dynamic changes of inner ear guinea pigs with 9.4Tesla MRI.Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi755(4):378-383.2020
■片山仁.私と造影剤の関わり.順天堂医学45(2).p176-183.1999