専門獣医師が解説する鳥類と爬虫類の血液検査〔Ver.2〕〔獣医師向け〕

目次
- 背景
- 鳥の採血の危険性
- 鳥の採血はどこでする?
- 爬虫類の採血はどこでする?
- 採血量はどれくらい?
- 鳥の採血シリンジ針は?
- 鳥は溶血しやすい・・・
- 採血後急いで測定して!
- 血漿が黄色?
- 爬虫類の正常値はない!
- 血球計算はナット&へリック液!
- 赤血球数
- 総白血球数よりも塗抹かも
- PCVはどうする?
- ヘモグロビン値はどうする?
- 血球観察が重要!
- 赤血球
- 好中球(偽好酸球)
- どれが好酸球なの?
- 好塩基球
- リンパ球
- 単球
- 感染や炎症が起こると・・・
- 血小板(栓球)
- 生化学検査は何を測定する?
- 蛋白質パネル
- 腎臓パネル
- 肝酵素パネルってどんな感じ・・・
- CPKは採血の筋損傷チェック!
- 将来に期待ビリベルジン
- 注目!BA!
- NH3は?
- 鳥と爬虫類でこんなに違うGlu
- 脱水評価のNaとCl
- 卵を持つと上昇する項目
- 膵炎指標のAMYL?
- 低温環境の爬虫類
背景
鳥類・爬虫類の血液検査は貧血や敗血症、内臓疾患などを診断するために有用なアイテムです。小鳥では採血することが危険でるという認識、爬虫類では採血部位の明確な指針が無いという問題から、敬遠しがちな検査になっています。これらの動物における測定値は、外因性および内因性の様々な要因によって過大な影響を受けることも欠点となり、測定した値の信頼性に疑問を持たざろうえない現状もあります。特に血液サンプルは採血や処理時の人為的なアーチファクトの影響を受けやすいため、動物病院スタッフ全員が、適切に処理することを共通した認識を持たないといけません。

鳥の採血の危険性
『小鳥に採血をすると死ぬこともある』とよく言われます。事実、採血の危険性ならびに保定による鳥への負荷がかかります。拘束をされた鳥は必ず逃れようとして抵抗するために血中飽和酸素濃度が低下し、チアノーゼやショック死することがありますので、病気の鳥の全てが採血できるわけではありません。特に呼吸器や循環器疾患がある鳥、また極度に暴れる鳥では危険性が増すことから、採血の際にはリスク判定をしっかりと行うことが重要です。

『鳥の採血で、血が止まりにくい』とも言われています。採血後の止血は注射針の穿刺具合によりますが、血管を引き裂くように穿刺すると血腫が起こりやすくなります。本来は鳥の頸静脈は静脈圧が低く、強い止血は不要です。止血のために強く長時間圧迫をすることは、鳥を興奮させて血圧を上昇させますので、注意して下さい。なお、鳥は血液の再生能力が高く、出血に対してはかなり抵抗性が強いため、重篤な疾病を持つ鳥以外では大きな問題になりません。
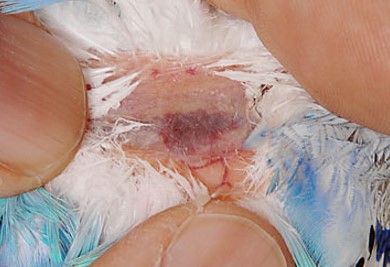
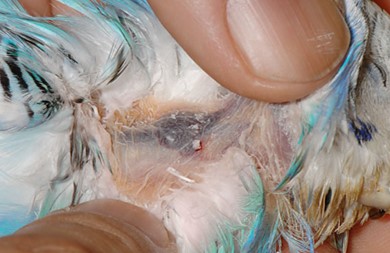
鳥の採血はどこでする?
鳥類の採血部位は、右頸静脈、上腕静脈、内側中足静脈、爪になります。やはり、重要なのは保定かもしれません。

右頸静脈
鳥類の右頸静脈は左側と比べて発達しているために太く、そして、オウム目やスズメ目では左右の頸部は無羽域なために、容易に血管が目視できます。右頸静脈は食道の背側を走行しています。しかし、ハトやアヒルなどでは頸部の無羽域を欠くため、他の採血部位を優先します。オカメインコまでの小型種では一人で保定して採血を行えます。首を人差指と中指で挟んで、首を伸ばすようにして保定します。親指で駆血して血管を怒張させますが、頸静脈は食道の下へ逃げやすく、また頸部気嚢に空気で膨らみやすいので、親指で広く押さえて怒張させるがコツです。大型種では二人で行い、タオルなどを使って首を伸ばすようにして保定します。



上腕静脈(翼下静脈)
上腕静脈は、前腕の浅尺骨静脈と深尺骨静脈が肘関節部で合流した起始部から、腋下静脈までを走行しています。採血は二人で行い、保定者は翼を広げで保定し、上腕部を駆血して穿刺します。

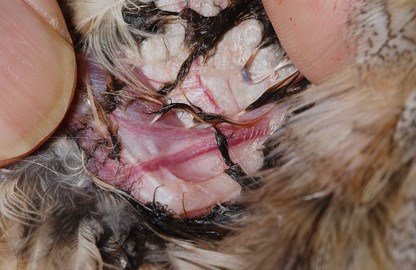
採血者は浅尺骨静脈と深尺骨静脈の二股になっている合流部を穿刺しますが、針は前腕部の腱の下を通して血管の下面から刺入するようにします。
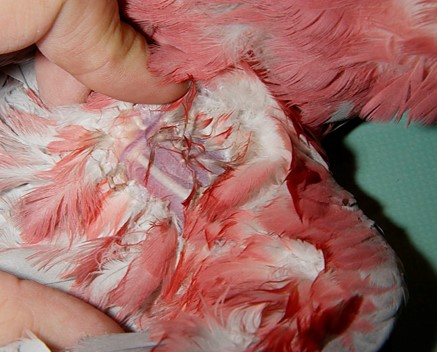
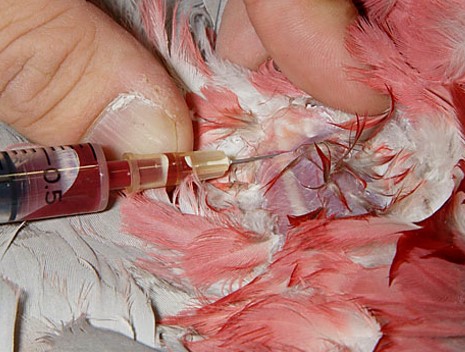
内側中足静脈(脛骨静脈)
内側中足静脈は跗蹠部の内側に位置し、第一趾付近を起始部とし、膝関節で外腸骨静脈へと走行しています。第一趾の頭側よりから
、頭側方向へ穿刺します。
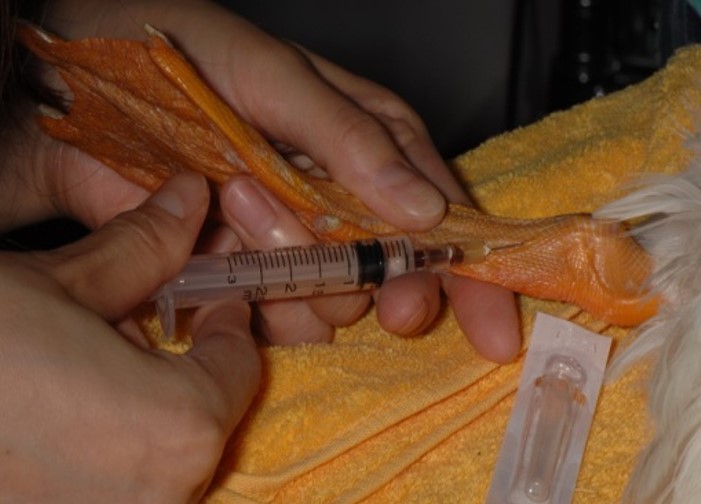
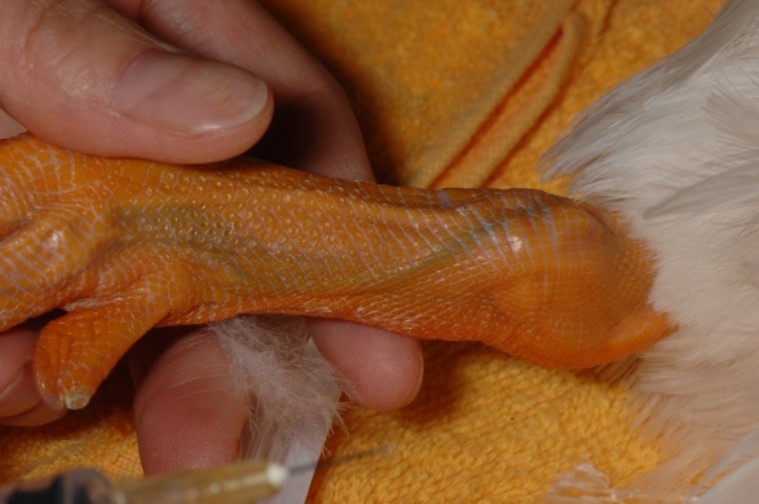
爪
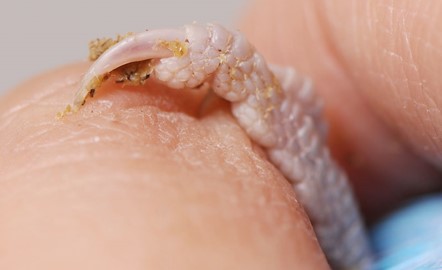
鳥の爪を深く切ることによって出血させ、出血した血液をヘマトクリット管の毛細管現象にて採取できますが、少量の採血にとどまるかもしれません。

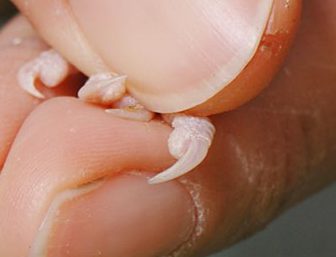
循環不良の鳥では爪を切ってもほとんど出血しないこともあります。しかし、爪から採取した血液では、静脈採血サンプルと生化学検査値が若干異なります(LDH、CPK、AST、UAが高めに測定される可能性があります)。爪の組織液混入や溶血、腎門脈の存在が原因と言われています。排泄物で爪が汚れている場合は、よく拭いてから採血をして下さい。そして、爪からの採血は、採血後に痛みを伴いますので、飼い主には事前に説明をしておくべきです。
爬虫類の採血はどこでする?
カメ、トカゲ、ヘビにおいて、それぞれ推奨される採血部位は異なります。鳥類よりも身体の大きさに幅があり、大きさに基づいて、1〜3ccのシリンジに21〜25Gの針が使用されます。なお、爬虫類はカメの頸静脈以外は体表血管でなく、身体内の血管から採血をするため、必然的に筋肉などの組織を穿刺するため、生化学検査でにCPKならびにASTなどが上昇しやすくなります。細胞外液が多く混入しやすいチャレンジ的な採血部位での血液サンプルは希釈もされやすく、血漿の組成が変化し、やはり生化学測定値の信頼性が落ちます。
爬虫類はリンパ液が混入しやすい・・・
爬虫類のリンパ管は血管周囲に走行しています。特にカメの採血ではよく見られ、リンパ管を穿刺することでリンパ液が混入しやすくなります。リンパ液で希釈された血液サンプルは、血球計算や生化学測定値にも大きく影響しますので、測定には不向きです〔Lopez-Olvera et al.2003,Gottdenker 1995〕。リンパ液の混入はどの採血部位でも起こる可能性がありますが、頸静脈からの採血が最も回避できます。
爬虫類の血管とリンパ管
ヘビ
ヘビの採血は一般的に心臓穿刺で行われ、腹側尾静脈からの採血はチャレンジ的です。ヘビから採血するために麻酔は不要です。口腔内の口蓋静脈からの採血は一部で行われていますが、臨床的には推奨されません。血腫になりやすいこと、保定および採血中に口腔粘膜を損傷しやすいからです。

心臓
経皮的に心臓を穿刺して採血をします。心臓は頭側から体全体の1/4~1/3に位置し、超音波装置のドップラーを使って確認して穿刺ポイントを見つけ、鱗間に穿刺します。ヘビを背臥に保定し、人差し指と親指の間で心臓を挟むようにして行うとよいです。針を45度の角度をつけて尾側から挿入すると、心室に入りやすくなります。『心臓に針を穿して大丈夫なのか』と思われますが、爬虫類は血圧も低く、的確な手技で行えば意外に問題は起こりません。ただし、心臓や主要な血管を引き裂く可能性があるため、穿刺後は針を探索のために左右に動かさないようにします。肝機能低下による凝固障害など疑えるヘビでは、穿刺することさえも危険かもしれません。

腹側尾静脈
腹側尾静脈は尾椎の真下を走行しているため、骨部の腹側正中線から穿刺します。オスの半陰茎(ヘミペニス)を避けるようにし、さらに尾部が短い種類が多いため、採血量も期待できず、難しい採血部位とされています。
トカゲ
トカゲの一般的な部位は腹側尾静脈で、チャレンジ的に心臓穿刺で採血をすることがあります。トカゲから採血するために麻酔は不要です。頸静脈や腹静脈からの採血もありますが、血管が目視ができず、ランドマークも明確ではありません。腹静脈は遊離性があり、穿刺によって引き裂いて体腔への出血しても、確認が難しいため、臨床的には推奨できません。
腹側尾静脈
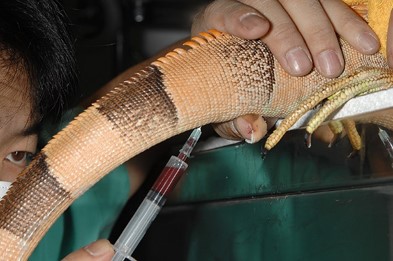
腹側尾静脈は尾椎の真下を走行し、尾の腹側正中線から穿刺します。穿刺部は総排泄孔から尾の先端までの距離の頭側1/4〜1/2になります。 オスのトカゲでは、尾の付け根の半陰茎(ヘミペニス)を避けるために理想穿刺部位の遠位領域で行います。なお、針は、椎体に到達するのに十分な長さを選ぶようにして下さい。グリーンイグアナなどの大型のトカゲでは体をタオルで包み込み、尾がテーブルから伸びるようにテーブルの端で保定するとやりやすいです。針は正中線に沿って椎骨に対して45度の角度で穿刺します。これは腹側棘突起間の通過を容易にするためです。
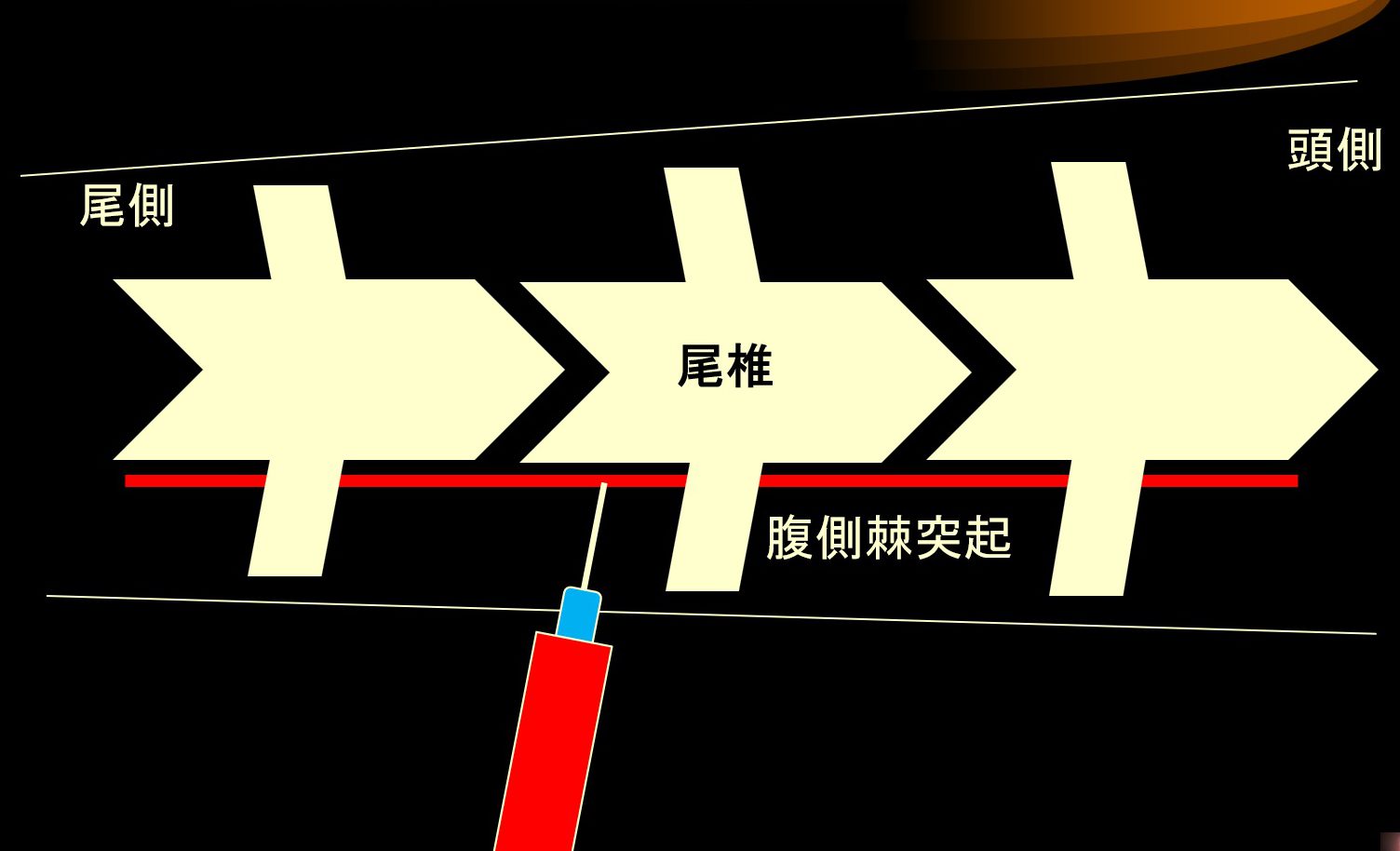
椎椎に接触するまでゆっくり進入させ、血流が見られたら、注射器に穏やかな陰圧をかけます。血液が見られない場合は、針の位置をわずかに動かして下さい。
中小型種では針だけを穿刺し、漏出した血液をヘマトクリット管の毛細管現象で最終することもあります。
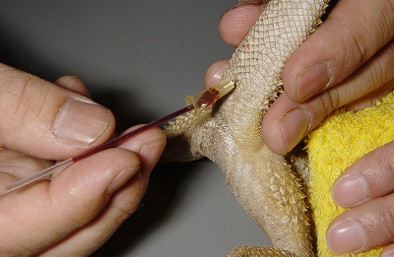
尾静脈は尾椎の横にも走行していますので、尾の筋肉の間に窪みから穿刺します。横の静脈は腹側よりも細いので、難しいです。
頸静脈
頸静脈採血採血はイグアナやオオトカゲなどの大型種で行わることがあります。通常、鼓膜と肩の間を走行していますが、目視できず、駆血しても、あまり目立つこともありません。
カメ
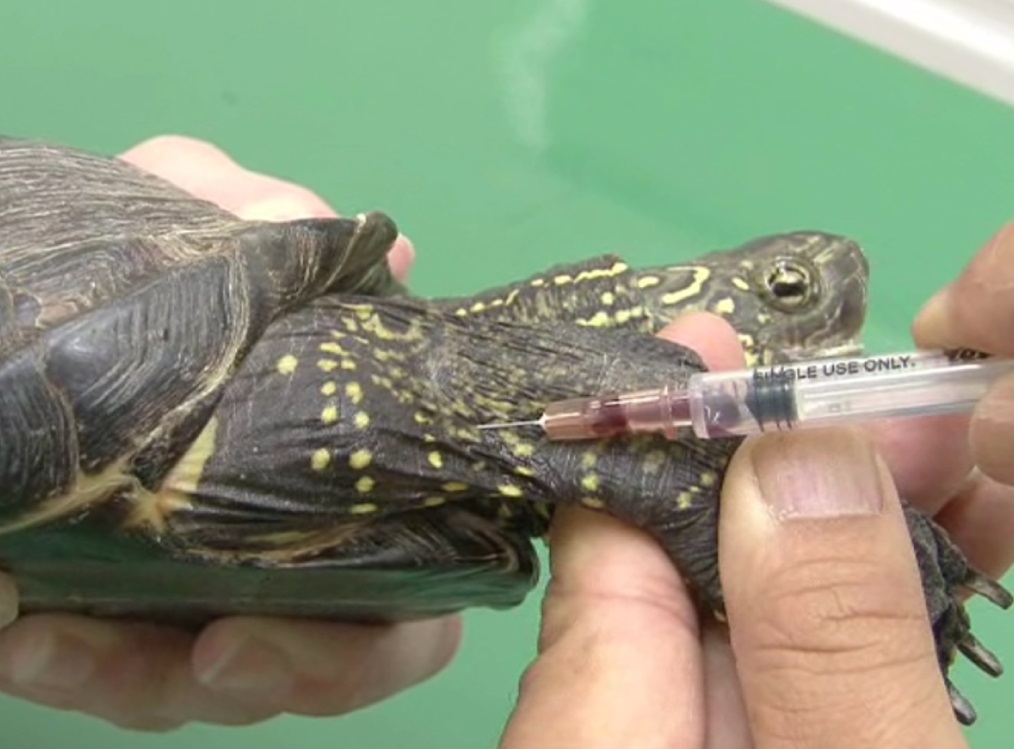
カメは甲羅に頭と四肢を引き込むため、無麻酔での採血が難しい場合があります。一般的な部位には、頸静脈、甲羅下(背甲)静脈、腕頭静脈になります。

頸静脈
頸静脈は、首の左右側面の鼓膜上縁の高さを走行しています。しかし、採血は、首を伸ばせるカメに限定されます。
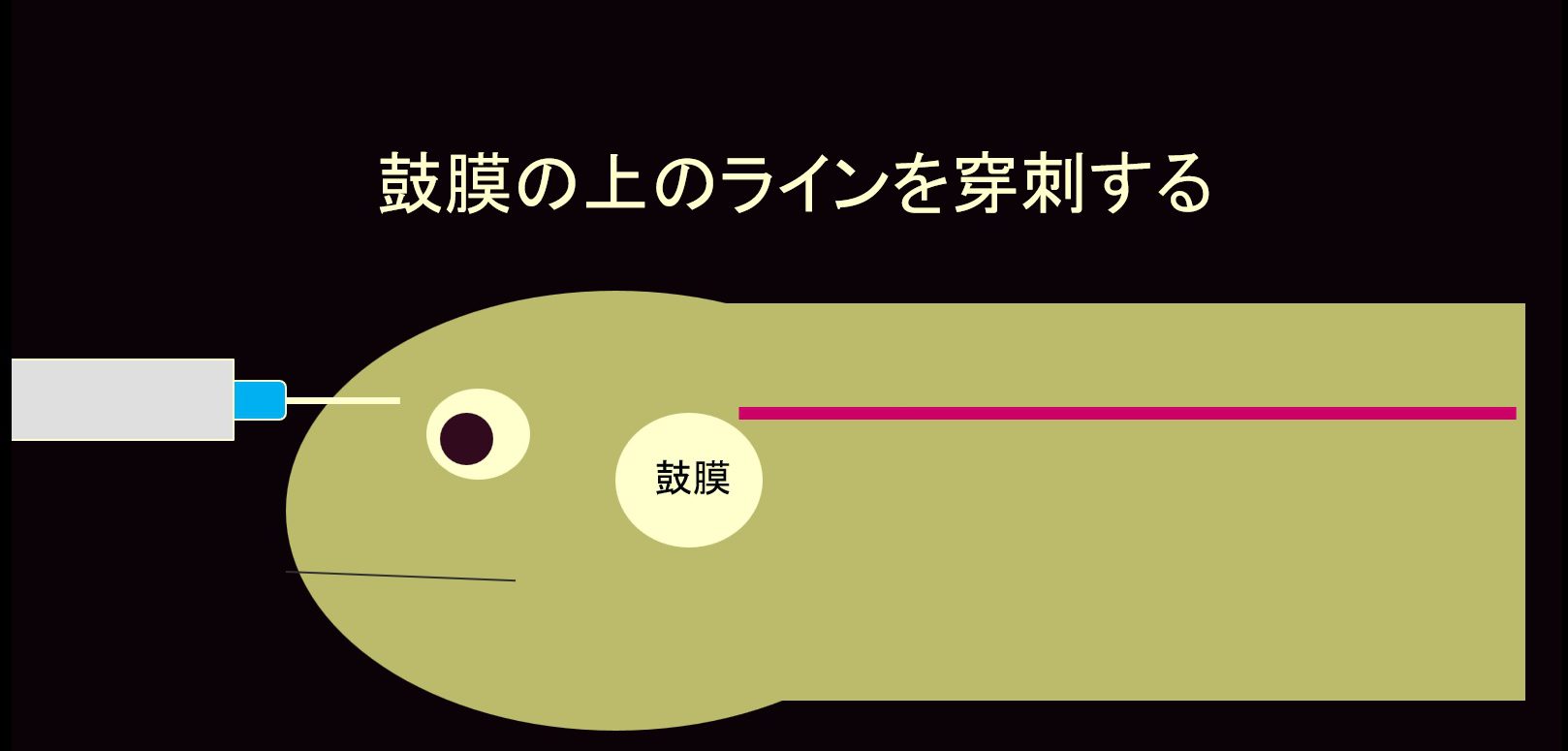
保定者が首の付け根を駆血することで、血管が怒張します。
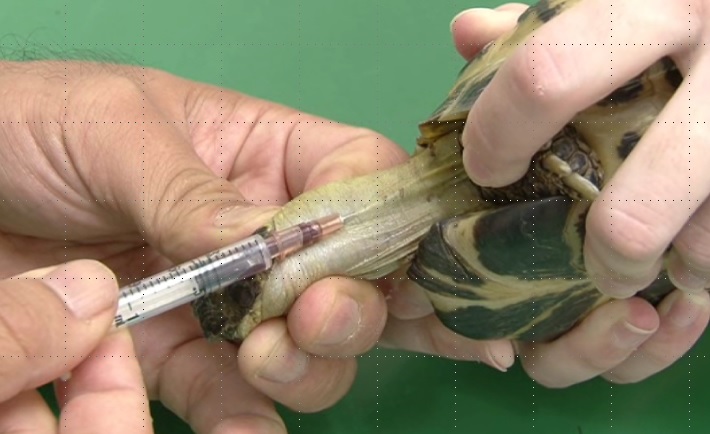
背甲静脈(甲羅下静脈)
甲羅下静脈は、頸椎が甲羅に結合する領域で、正中線に沿って走行しています。この領域では、一般的な肋間血管や外頸静脈の尾側頸部枝など、いくつかの血管によって静脈洞を形成しています。時に背甲静脈採血はリンパ液の混入のリスクが高いです〔Barrows et al.2004〕。
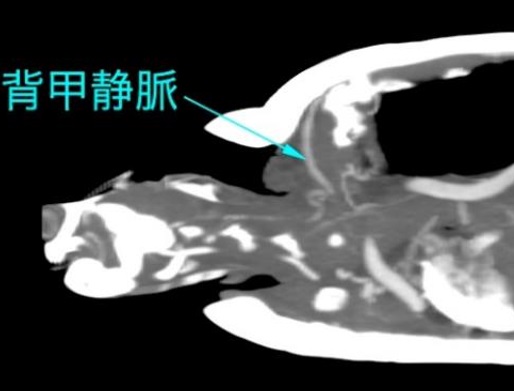
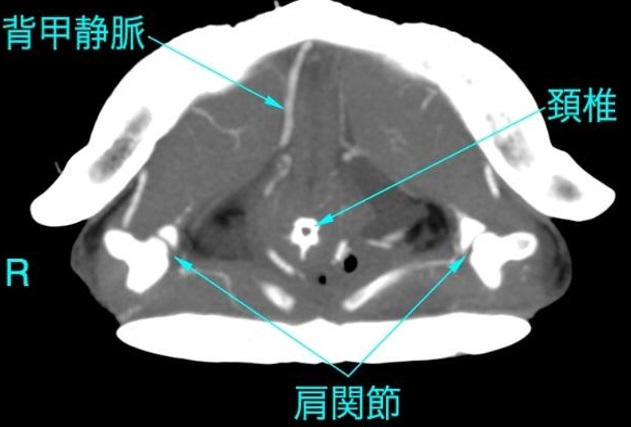
カメはテーブルの端に置かれ、前肢は拘束されます。静脈穿刺を行う人は、頭を伸ばして首を腹側に曲げるか、頭を甲羅内に押し戻します。頭と顔の上にガーゼまたは綿球を置くことで、採血者がかまれるのを防ぐことができます。しかし、中大型のカメでは、血管に到達するために6~8cmの皮下注射針を使用しなければなりません。針は背尾方向に向けられ、皮膚が頭蓋甲の腹側に付着する点で正中線に挿入されます。穏やかな陰圧を維持しながら、血液が吸引されるか甲羅に到達するまで、針を背側に進めます。血液が吸引されない場合は、血液が現れるまで針をわずかに引き抜いて方向を変えます。

腕頭静脈(上腕静脈)
腕頭静脈は肘関節の腹内側(屈筋)表面を走行している血管で、より大きな個体の採血に使われます。カメは腹側臥位で前肢を伸ばして保定します。針は上腕骨関節の腹内側にある突出した上腕二頭筋腱の上の溝に上腕骨に対して垂直に穿刺し、血液が吸引されるまで、針を関節に向かって進めます。いくつかの研究では、他の採血部位と比較してリスクが低いと言われていますが〔Zaia et al.2006,Lopez-Olvera et al.2003〕、首と同様に前肢を伸ばして保定することは容易ではありません。
他の部位
大腿静脈、背側尾静脈、頭蓋下静脈(背後頭静脈)などがチャレンジ的に行われています。大腿静脈は大腿骨の腹側表面を走行していますが、無麻酔では後肢を伸ばすことができず、血管のランドマークも明確でないので、難しい採血部位です。背側尾静脈は尾の背側正中を走行しています。尾を持って伸ばし、針を背側正中線の頭側に向かって挿入します。 針が椎骨に接触し、わずかに吸引すると血液が注射器に吸引されます。頭蓋下静脈は頭蓋の尾側を走行し、針を垂直からやや尾側45度に傾けて穿刺します。

採血量はどれくらい?
鳥の総血液量は体重の10%、爬虫類では5~8%〔Heard et al.2004〕と言われ、このうち採血可能量は10%です。つまり鳥では体重の1%まで、爬虫類では0.5~0.8%であれば、安全に採血可能です。
表:鳥類と爬虫類の安全採血量
| 種類 | 安全採血可能量の上限 | |
| 鳥類 | セキセイインコ(体重35g) | 0.35mL |
| オカメインコ(体重90g) | 0.9mL | |
| 爬虫類 | フトアゴヒゲトカゲ(体重300g) | 1.5~2.4mL |
| リクガメ(体重1kg) | 5~8mL | |
鳥の採血シリンジ針は?
小型の鳥の採血は少量のサンプリングなため、オカメインコ以下の小鳥ではマイジェスターシリンジ29G、それ以上では27G針をつけた1㏄のシリンジを使用します。なお、鳥類の血液は溶血しやすいため、針を通してチューブに移さない方がよいです。ギロチン式の爪切りでシリンジを切り落としてうつすようような工夫もするとよいです。
鳥は溶血しやすい・・・
小鳥や小型の爬虫類の採血では細い針を使用するため、内筒を早く引いて陰圧になり過ぎると、容易に溶血します。溶血の影響は数多く報告され、爬虫類(グリーンイグアナ)では、K、TP、ASTの測定値を有意に増加させた報告があります〔Benson 2014〕。
採血後急いで測定して!
採血後できるだけ早く検査を実施する必要があります。時間をおくと測定値が変動しやすくなることは勿論ですが、鳥類や爬虫類の血球の染色性に影響が見られます。
抗凝固剤の選択が重要
抗凝固剤への長時間の曝露は、特に鳥類や爬虫類の血球形態を歪める可能性が高くなります。EDTA処理した血漿はカルシウムを測定することはできず、鳥類や爬虫類では溶血を起こすことがあります。しかし、その溶血も種類毎の相違もあるようで、鳥類ではダチョウが起こりやすいとか〔Freidlin 1985〕、家禽でも赤血球浸透圧の脆弱性に品種差があるそうです〔Oyewale et al.1988〕。したがって、抗凝固剤は必然的にヘパリンを使用しますが、へパリンはリチウムへパリンが理想で、ヘパリンナトリウムは電解質測定に影響するので注意して下さい〔Samour 2006〕。なお、長時間のヘパリン処理された爬虫類の血液サンプルは、白血球の染色性が不十分になったり、細胞の形態に影響を及ぼす可能性も示唆されています〔Nardinin et al.2013,Campbell et al.2007〕。選択した抗凝固剤に関係なく、血液塗抹標本は直ちに作成する必要があります。 これにより、細胞の形態が維持され、白血球の凝集やサンプルのアーチファクトを防ぐことができます。迅速に採血ができるようであれば、抗凝固剤は使用せずにそのまま全血あるいは血清で測定することも一方法です。
核周囲リングができちゃう
血液塗抹標本作成は、採血後にすばやく作成することを心がけて下さい。乾燥が遅すぎると、赤血球の核周囲にリングまたは不規則な屈折空間がアーチファクトとして見られます。これらを血液原虫と混同しないように注意して下さい。犬や猫と比べて血液を綺麗に塗抹するのが難しく、カバースリップとスライドのどちらの方法にせよ、何枚か作成して、顕微鏡で観察し血球が壊れていない標本で評価するつもりでもよいかもしれません。


特に鳥類では塗抹作成の手技が未熟だと、白血球が崩壊しやすく、崩壊した白血救をSmudge細胞(にじみ細胞/ぼかし細胞)と呼ばれます。
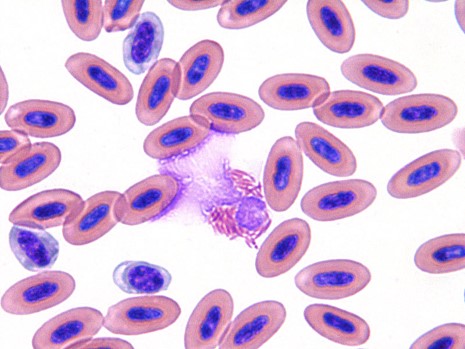
カメの赤血球は爬虫類の中で最も大きく、長さは約20 µmです〔Saint Girons 1970〕。したがって、小さい針(22G未満)での採血は、赤血球の破裂を引き起こしやすくなり〔Perpiñán et al.2006〕、溶血が起こりやすいです。赤血球がカメより小さいトカゲでは、血球の破裂は少ないと言われています〔Stahl 2006,Nardinin et al.2013,Campbell et al.2007〕。
血漿が黄色?
鳥類と爬虫類の血漿色は無色透明~薄黄色で〔Harr 2006〕、グリーンイグアナなどの草食動物ではカロテノイド色素により、黄色~オレンジ色を帯びています。


パイソンなどの一部のヘビも、カロテノイドとリボフラビンによって緑色を帯びた黄色をしています。血漿色が濃い黄色や緑色は通常、ビリベルジンによる肝疾患の兆候である可能性がありま。赤色を帯びている場合は溶血、いわゆる採血時のアーチファクト、敗血症、鉛中毒などが疑えます。乳糜は特に鳥類で多く見られ、食後、甲状腺機能低下症、糖尿病、膵臓疾患などが疑われます。溶血や乳糜の場合は測定値が変動することがあるので、信頼性が落ちます。
爬虫類の正常値はない!
爬虫類の血液検査測定値は正常値というより基準値で評価しなければなりません。外的要因(季節、気温、エサ、疾病、 ストレス、静脈穿刺部位)および内因性要因(種類、性別、年齢、生理学的状態)が測定値に影響を与えます〔Joseph 2005〕。爬虫類は外気温動物であるため、外気温によって生理機能が変動するため、季節温度により、血球計算と生理化学検査の測定値が変動し、夏と冬とで変動します〔Gilles-Baillien 1973,Lawrence et al.1986〕。しかしながら、一年中照明や温度を一定にしているようなペットでは、季節的な変動は少ないそうです〔Pejřilováetal.2004〕。爬虫類の血液検査は、例え基準値から外れていても、動物の状態や飼育環境から測定値をどのように変動させたか、考慮しながら診断しなければなりません。経験を踏まえて判断することが必要となるので難しいかもしれません。

血球計算はナット&へリック液!
鳥類と爬虫類の赤血球と血小板(栓球)は有核細胞なため、犬や猫で使用する自動血球計算機は使用できず、染色してた血液サンプルを手動で計算板を使って計測します。現在最も使用されているのがNatt氏とHerrick氏が開発した染色液を使ったNatt and Herrick液法になります。この染色液は赤血球と白血球を同時に染色し、2年間の長期保存が可能です〔Natt et al.1952〕。しかし、Natt and Herrick液の欠点は、赤血球や白血救の鑑別、そしてリンパ球と血小板(栓球)が類似して染色されるため、ある程度の訓練が必要になります。Natt and Herrick液は試薬を自ら調合する手間もかかります。

コラム:哺乳類はなぜ脱核したのか?
哺乳類の赤血球には核がありませんが、それ以外の鳥類、爬虫類、両生類、魚類などの赤血球は核がある有核赤血球です。 哺乳類でも赤血球分化の過程において、赤血球の前の段階である赤芽球までは核を持っていますが、赤芽球の最終段階で核が細胞外に放出される脱核という現象が生じ、無核になります。 脱核したことで、中央が窪んだドーナッツ状の形態になり、赤血球がをヘモグロビンの入った袋として、酸素運搬だけに特化しています。核や細胞内小器官がなくても嫌気的解糖系だけで必要なエネルギーは得られています〔Kobayashi et al.2016〕。では、哺乳類の赤血球が無核になることでの生体における有利性についていくつかの仮説があります。核を放出することで、血球が小型化され、より細い血管も通過できます。さらに中心が窪んだドーナツ状の形状は、その方が変形しやすく、直径よりも細いところでも、浮き輪を引っ張ったような細長い形になることで、通過が容易になります〔Chasis et al.2008〕。この他にも色々と諸説がありますが、明確には分かっていません。.しかし,毛細血管の通過は哺乳類に限ったことではありません。
哺乳類が誕生した中生代の環境から、脱核した理由を考察してみましょう。約2億5千万年前のペルム紀と三畳紀に起きた恐竜の大量絶滅後の中生代は約15%の低酸素環境下になり、哺乳類と恐竜類が同時に進化し〔Ward 2006, Svensmark 2007〕、この低酸素環境下で生き延びるために哺乳類は腹式呼吸を獲得し、一方で恐竜は現存の鳥類のように肺に付属した気嚢という空気の貯留器官が発達し、肺にはいつも新鮮な酸素が供給されます。この中生代の約2億年の間,哺乳類は体長が小さかったが、進化速度が速く、哺乳類の祖先で,赤芽球が脱核する個体が誕生したと言われています。気囊を備えた爬虫類は鳥類へと進化し、鳥類の赤血球は有核のままです。有核赤血球であると哺乳類の酸素交換に特化した無核の赤血球よりは非効率ですが、逆に鳥のヘモグロビンは哺乳類より酸素を分離しやすくなっています。また鳥の肺は哺乳類と違って息を吸うときも吐くときも酸素を取り込める気嚢を備えています。赤血球の核の有無では哺乳類の方が進化していますが、肺やヘモグロビンでは鳥の方が進化しているともいえます。
表:Natt and Herrick液の組成
| 材料 | 量 |
| 蒸留水 | 1000mL |
| NaCl | 3.88g |
| Na2SO4 | 2.5g |
| Na2HPO4 | 1.74g |
| KH2HPO4 | 0.25g |
| ホルマリン(37%) | 7.5mL |
| メチル紫2B | 0.1g |
最近はNatt-Herricks-Tic®という既製品も販売されて便利になりましたが〔Carisch 2019〕、海外のサイトから購入するしかありません。
用意するもの
●Natt and Herrick液またはNatt-Herricks-Tic®(以下NH液と略する)
●血球計算盤
●濾紙(#1ワットマン)
●マイクロピペット
手順
①NH液に沈殿物が見られる場合は濾紙で濾過をします。②マイクロピペットを使用して抗凝固処理した血液をNH液で1:200の割合で希釈します。
③希釈した血液を1〜2分間混合します。
④血球計算盤のカウントチャンバーに混合した液を充満し、約3分間静置します。
総赤血球数の算出
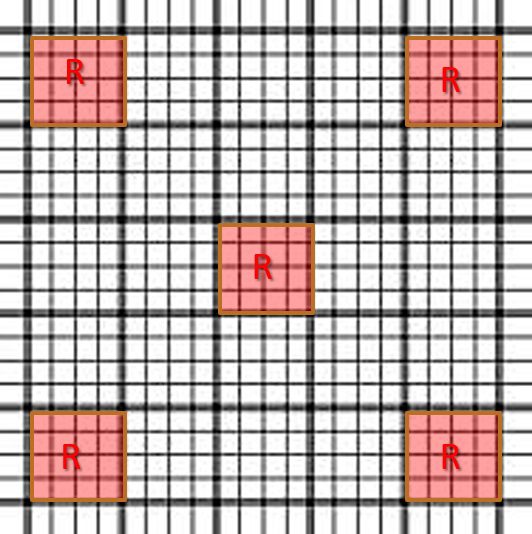
⑤顕微鏡の40倍対物レンズを使用して、カウントチャンバーの中央の正方形の中の、四隅と中央の正方形にある赤血球の総数をカウントします。
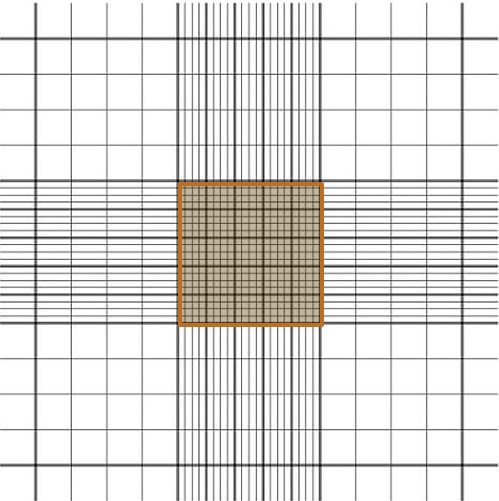
⑥赤血球は淡い桃色の楕円形の細胞質と薄紫色の核をしており、判断しやすいです。円形の紫色~青色の顆粒状の細胞が顆粒球です。
⑦カントされた細胞総数(R)に10,000を掛けて、1μLあたりの総赤血球数を算出します。
R ×10,000=総赤血球数(/μL)
総白血球数の実行
⑧白血球数は、血球計算盤の9つの大きな四角に存在するすべての白血球を数えることによって得られます。
➈円形の紫色~青色の顆粒状の細胞が顆粒球です。
栓球も染色されることがあり、リンパ球と間違いやすいです。
⑩カントされた9つの正方形の白血球総数(W)+総WBCの10%に200を掛けて、1μLあたりの総白血球数を算出します。
(W+Wの10%)×200=総白血球数(/μL)
過去には別の白血球の定量的カウント方法として、好酸球用ユノペットが使用されていました〔Campbell et al.1984,Dein et al.1994〕。この方法は、鳥類の好酸球と偽好中球(ヘテロフィル)が赤色染料であるフロキシンBに染色される原理です。しかし、現在は製造中止になったため、フロキシンBの主成分であるランドルフ液で染色する方法が行われています。好酸球と偽好中球(ヘテロフィル)の数を総じてカウントし、次いで血液塗抹標本における白血球の百分比から総白血球数を算定する間接的方法にCampbell et al.19184,Dein et al.1994〕。白血球の百分比を確認して関節的にカウントするために精度は必然的に低くなりますので〔Walberg 2001〕、現在あまり行われていません。Natt and Herrick法の算定値と比べてかなりの相違があると報告されています〔Dein et al.1994〕。
赤血球数
| 増加 | 脱水 |
| 低下 | 貧血 |
赤血球数の低下は、貧血によるもので、同時にPCVの減少も見られます。鳥類の赤血球数の増加はまれで、多くは脱水で起こります〔Clark et al.2009〕。鳥類は予備の赤血球を脾臓に保存しないため、赤血球の再分布による相対的な赤血球増加は見られません。真性赤血球増加症〔Campbell et al.2007,Mitchell et al.2008〕、骨髄増殖性疾患〔Clark et al.2009〕、二次性赤血球増加症(慢性肺疾患、心臓病、鉄貯蔵病、くる病、腎疾患)も鑑別に入れますが〔Mitchell et al.2008,Clark et al.2009〕、多くはありません。鳥類と爬虫類では、年齢、性別、季節/環境、およびホルモンの影響によって変動します〔Campbell et al.2007,Doneley et al.2007,Mitchell et al.2008,Fair et al.2007〕。性差においては、鳥類も爬虫類もオスはメスよりも赤血球数が高値になります〔Harr et al.2013, Romagnano 2014〕。冬眠中の爬虫類では、赤血球数は冬眠前に最も高く、冬眠後に最も低くなります〔Heatley 2014〕。
コラム:爬虫類の赤血球は種類によって大きさが違う
爬虫類では種類により、赤血球パラメーターに相違があることを頭にいれて評価して下さい。表2のように、カメはトカゲよりも赤血球パラメーターが低値です。赤血球の大きさと赤血球数は反対の関係にあり、カメなど赤血球が大きい種類だと赤血球数は少なく、ヘビは中間、トカゲなど赤血球が小さい種類だと赤血球数は多いです〔Heatley 2014〕
表2:カメとトカゲの赤血球パラメーター /div>
ヘルマンリクガメ(※1) グリーンイグアナ(※2) RBC(×106/μL) 4.9 10.0-17.0 PCV(%) 24.4 29.2-38.5 Hb(g/dL) 6.146 6.7-10.2 MCV(fL) 514.8 228-303 MCH(pg) 26.32 22.7-28.0 ※1:Muro et al.J Zoo Wild Med 29.40-4.1998
※2:Frye FL. Biology,Husbandry,and Medicine of the Green Iguana.Krieger Publishing. Florida. 2002
貧血の評価
貧血は病態生理に応じて、再生成貧血(溶血性や出血性)、非再生成貧血(形成不全)に分類されます。なお、鳥類は赤血球の寿命が約30日と爬虫類よりも短く、比較的、多染性赤血球や網状赤血球が少数発現し、PCVも35~55%です。爬虫類はトカゲよりもカメの方が赤血球が少ないのも特徴です。なお、爬虫類で赤血球パラメーターが低値の場合、リンパ液混入による血液希釈がなかった再確認して下さい。また、冬眠や低温で飼育されていた爬虫類では低めになります。リンパ液混入や低温環境でない場合は貧血が示唆されます。
再生成貧血鳥類の再生性貧血は、血液寄生虫、細菌性敗血症、急性中毒症、免疫疾患、外傷、胃腸の寄生虫症〔Campbell et al.2007〕などが原因です。鳥類も爬虫類も、多染性赤血球や網状赤血球の増加、赤血球大小不同を特徴とし、最も多い原因は外傷です。
非再生成貧血鳥類も爬虫類でも実際に多く見られるのが非再生性貧血です。骨髄反応のトラブルを示し〔Fudge 1997〕、慢性炎症や慢性感染症、ウイルス性疾患、中毒、鉄欠乏、内分泌障害などが原因になります。
総白血球数よりも塗抹かも
白血球から得られる情報は臨床上重要ですが、ストレスでも増加します。特に鳥類では保定することが過大なストレスになりますので、総白血球数が増加してもストレスか病気であるのかの判断が難しいです。
| 増加 | ストレス、全身感染症、炎症性疾患 |
| 低下 | 敗血症、ウイルス感染の初期 |
総白血球ならびにヘテロフィル減少はまれですが、病気と判断する前にアーチファクトであるのか確認する必要があります。血液塗抹標本にかなりの数の破裂した白血球(Smudge細胞:にじみ細胞/ぼかし細胞)がある場合は、塗抹作成あるいは採血時の強い吸引などのアーチファクトの可能性があります〔Fudge et al.2000〕。アーチファクトが無ければ、敗血症やウイルスの感染症時に、白血球の消費または産生の減少を反映しています。なお、 貧血、血小板減少症を伴う白血球減少症は、骨髄の障害を示唆しています。したがって、総白血球数を算定すると同時に血液塗抹標本を作製して白血球を観察することも必ず行って下さい。また、白血球数のカウントができない時、採血量を多く採れない病態の鳥においても爪からの微量な血液で塗抹標本を作製し、大まかな総白血球数を目視で確認し、白血球の百分比と中毒性変化などを確認します。
PCVはどうする?
採取した血液をヘマトクリット管に入れて遠心分離器をかけ、固体である血球と液体の血漿に分けてPCVならびにヘマトくリット値を測定します。小鳥や小型爬虫類では血液サンプルが少ないため、一般的な大きさのサイズのヘマトクリット管ではなく、マイクロヘマトクリット管を使用するとよいです。


その測定後に、わずかな血漿をサンプルにして、屈折系を使って手動でTPを測定することもできます。
| 増加 | 脱水 |
| 低下 | 貧血 |
ヘモグロビン値はどうする?
自動血球計算機は赤血球を溶血剤で破壊し、ヘモグロビンを溶出して測定しますが、溶血剤はシアン化カリウムを使用しなければならないと報告されている〔Campbell 1988〕。しかしながら、現在の犬や猫で使用されている自動血球計算値での溶血剤は主に第4級アンモニウム塩の界面活性剤であり、溶血作用が弱いかもしれませんが、それらの装置を使用してヘモグロビン値を測定するしかありません。

| 増加 | 脱水 |
| 低下 | 貧血 |
鳥類の赤血球のヘモグロビン濃度はやや濃く、PCVは35~55%と哺乳類と大差はないです〔Terry et al.2010〕。ただし、鳥類のヘモグロビンは哺乳類のものとグロビンの構造が異なり、酸素解離曲線が哺乳類より右方変異しており、筋肉などの組織内で酸素を遊離しやすくなっています。
コラム:鳥のヘモグロビンは強力
鳥の赤血球は楕円形で、哺乳類と異なり中央に卵円形の核を有する有核赤血球である。赤血球の半減期は犬や猫と比べて短く、この短い半減期のために〔Glomski et al.2011〕、鳥が貧血しやすい。鳥類は哺乳類と同様に赤血球の酸素結合にはヘモグロビンが関与している。赤血球のヘモグロビン 濃度を調査した研究では、細胞体積を考慮した場合、平均細胞ヘモグロビン 濃度 (MCHC) は鳥類と哺乳類で変わらない〔Snyder et al.1999,Scanes 2016,Hawkey et al.1991〕。 しかし、鳥類の酸素解離曲線は右へ偏っていることから相対的に酸素供給効率がよい〔Storz 2016〕。つまり酸素運搬能の効率が高く、飛翔などのより激しい運動を可能にしている。なお、哺乳類は脾臓に赤血球を貯蔵することができ、運動などの刺激に反応してヘマトクリットとヘモグロビン値を急速に上方制御できるが、鳥類の脾臓は赤血球を貯蔵することはできません〔John 1994〕。脾臓は豆状で胃に接して位置しています〔Mckibben et al.1996〕。
表:爬虫類の血球計算測定値
| カロリナハコガメ | ミシシッピアカミミガメ | グリーンイグアナ | フトアゴヒゲトカゲ | ボアコンストリクター | ボールパイソン | |
| RBC(×106/μl) | 0.49(±0.47) | 0.3‐0.8 | 1.05‐3.5 | 0.8‐1.2 | 1.0‐2.5 | 0.3‐1.3 |
| PCV(%) | 25.6(±3.2) | 25‐33 | 30‐45 | 27(17‐50) | 20‐40 | 16‐21 |
| Hb(g/dl) | 5.0(±0.2) | 8.0 | 6‐12.2 | 8.4‐11.4 | 3.3‐15.3 | 5.5‐7.9 |
| WBC(×103/μl) | 5.1(±2.34) | 3.2‐25.5 | 3‐14 | 12.1(6.7‐19.9) | 4‐10 | 7.9‐16.4 |
| ヘテロフィル(%) | 41‐44 | 36 | 40‐70 | 17‐43 | 20‐65 | 56‐67 |
| 好酸球(%) | 25-30 | 11 | 0‐1 | ― | 0.3 | ― |
| 好塩基球(%) | 0-3 | 25‐27 | 0.2 | 9(2-18) | 0-20 | 0.2 |
| リンパ球(%) | 26-28 | 24 | 20‐45 | 59(47-69) | 10-60 | 7-21 |
| 単球(%) | 0-4 | 0-1 | 0‐2 | 1(0-4) | 0-3 | 0‐1 |
| アズロフィル(%) | 0-6 | 3-4 | ― | 4(0-9) | 0-6 | 12-22 |
血球観察が重要!
血球計算ができない場合は、血液塗抹標本から血球を観察します。爬虫類は赤血球と血小板(栓球)に核を持つ有核細胞であることを忘れないで下さい。
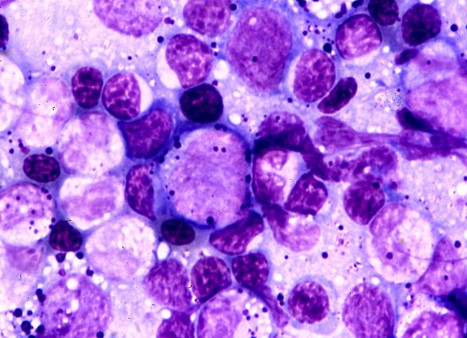
コラム:血球はどこで作られるのか?
鳥類と爬虫類の有核赤血球および顆粒球の分化は、骨髄で行われます。その組織像はおよそ哺乳類のそれに匹敵するといわれています〔クンケールカセムら 2014〕。なお、種類によって肝臓および脾臓などで髄外造血が行われます〔Joseph 2005〕。鳥類では,Tリンパ球は胸腺、Bリンパ球は鳥類特有のファブリキウス嚢で分化・成熟します(鳥類では性成熟に伴ってファブリキウス嚢は退縮します)〔Glick 1956〕。
インコの骨髄細胞
赤血球
鳥類も爬虫類も赤血球は楕円形をしており、ライトまたはロマノフスキー染色で染色すると赤色~桃色の細胞質を持ち、楕円形の核は暗紫色に染色され、核のクロマチンは一様に凝縮されています。未熟な赤血球はより大きく、 好塩基性細胞質を持ち、高い核/細胞質(N/C)を伴います。 赤血球が老化するにつれて、クロマチンはより凝縮します〔Campbell et al.2007,Mitchell et al.2008〕。
インコの赤血球
鳥類
鳥類の赤血球は人の赤血球よりやや大きく、11×6~16×10µm程度で、人の赤血球の直径7~8µmより若干大きめです〔Terry et al.2010〕。細胞も核も楕円形ですが、その形状は滑らかで、楕円形の核があり、鳥類の種類間でも外観はほぼ均一です。鳥類の赤血球の寿命は短く約30日です〔Terry et al.2010〕。爬虫類よりも多染性赤血球も多く散見されます。鳥類の赤血球造血もエリスロポエチンに反応し〔Terry et al.2010〕、その成熟過程は核が脱核しないこと以外は哺乳類の赤血球の成熟過程に似ています〔越田ら 1984〕。
爬虫類
爬虫類の赤血球は一般に鳥類や哺乳類の赤血球よりも大きく、特にカメは20×10µmと大型で、核の形状はややいびつです〔越田ら 1984〕。生物進化にしたがって赤血球のサイズを小さくして数を増やした傾向があります〔Hawkey et al.1991〕。爬虫類の赤血球の平均寿命は、種によって異なりますが、600〜800日〔Altland 1962〕と長いです。爬虫類は基礎代謝が低く、血球再生も遅く、赤血球の寿命に影響を与えていると思われます。
これが多染性赤血球だっ!
多染性赤血球は成熟赤血球よりもやや大きくて丸味を帯び、好塩基性の細胞質で、成熟赤血球に比べ濃縮されていない大きな丸味を帯びた核をしています。多染性赤血球の増加は、貧血に対する再生反応を示唆し、わずかな赤血球大小不同と奇形赤血球症も観察されます。

多染性赤血球はニューメチレンブルー染色で染色すると網状赤血球として現れます。
インコの網状赤血球
鳥類
鳥類の赤血球半減期は比較的短く(28〜45日)、総赤血球の1〜5%に多染性赤血球が出現します〔Campbell 2010〕。
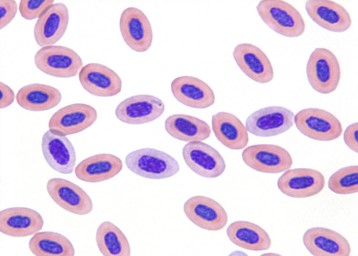
インコの多染性赤血球
爬虫類
爬虫類の赤血球の寿命が長いために、多染性赤血球は哺乳類と比べて少数しか観察されません。 貧血以外にも、非常に若い個体や脱皮中に多く見られることもあります〔Nardinin et al.2013,Campbell et al.2007,Campbell 2014〕。
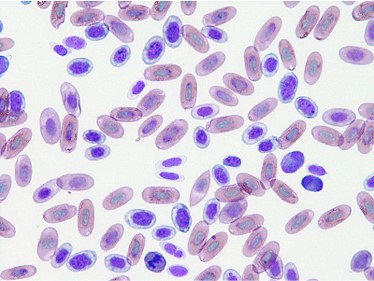
トカゲの多染性赤血球
奇形赤血球?アーチファクト?
鳥類や爬虫類の楕円形の有核赤血球は形状的に、そして綺麗な塗抹標本を作製しにくことから、正常でない形状の赤血球が頻繁に観察されます。核周囲の輪や細胞質の難染色部位は通常アーティファクトになります。それが異常である奇形赤血球や血液原虫であるのか判断するのは熟練していないと容易ではありません。
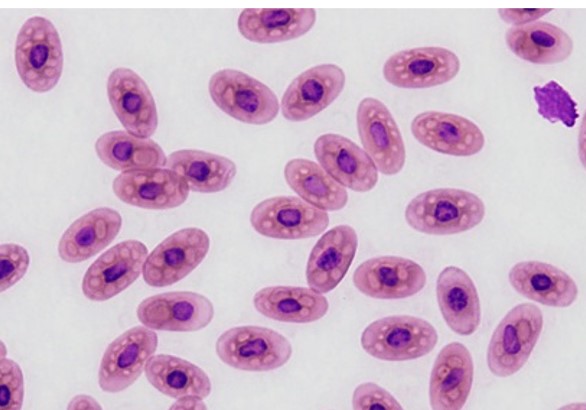
アヒルの赤血球のアーチファクト
奇形赤血球として、無核赤血球、核位置が変異した赤血球、核が突出した赤血球、双極または片極性の有棘赤血球が見られることがありますが、これらは貧血の際に出現する以外に、やはりアーティファクトが考えられます。未成熟な円形または卵円形の核をもった円形赤血球が、時折見つかることがあります。これは、加速した赤血球生成に起因する核および細胞質の非同期成熟を示しています〔Campbell et al.2007,Campbell 2010〕。
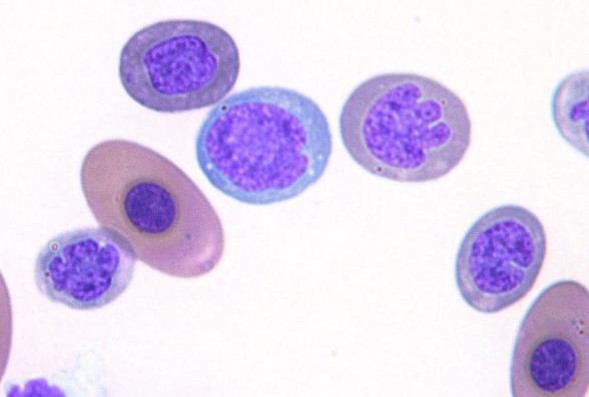
トカゲの赤血球の非同期成熟
非同期成熟した赤血球は中リンパ球または反応性リンパ球と間違えやすいので注意しなければなりません。
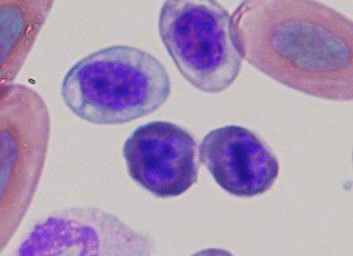
トカゲの赤血球の非同期成熟
奇形赤血球は損傷を受けやすく、他の赤血球よりも半減期が短くなります〔Fudge 1997,Capitelli et al.2013〕。無核化された赤血球はプラスチド(Plastid)細胞と呼ばれます〔Clark et al.2009〕。
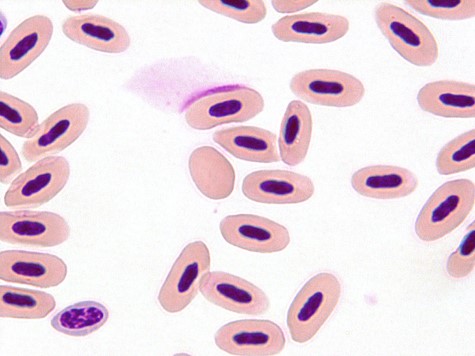
インコのプラスチド細胞
異常な赤血球形成を示す二核赤血球が、重度の慢性炎症性または腫瘍形成過程に関連します〔Capitelli et al.2013〕。
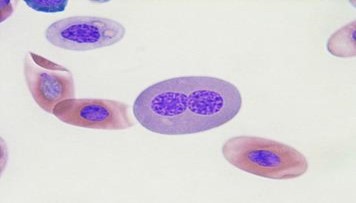
トカゲの二核赤血球
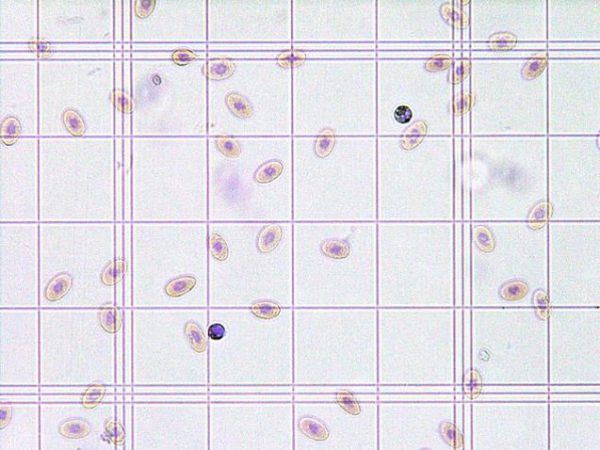
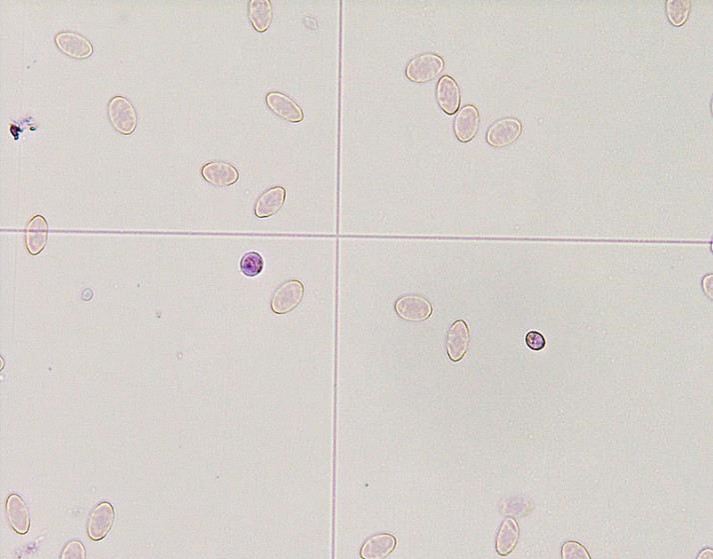
爬虫類の血液原虫?
文献で記載されている血液寄生虫の数は膨大であり、現時点では、最も一般的な種類ついてのみ解説します。血液寄生虫は細胞内に見られるか、血漿中に遊離している種類もいます。
鳥類
鳥類に寄生する血液原虫の主なものとしては、Plasmodium 属、Haemoproteus属,Leucocytozoon
属、Trypanosoma属などが有名で、媒介ベクターを介して感染します。多くは無症状で経過しますが、寄生虫の種類あるいは鳥の状態によって発症するかもしれません。この中でPlasmodium属の原虫による感染症は鳥マラリア(Avian malaria)と総称されますが、本症の病原体にHaemoproteus 属原虫を含める場合もあります〔Pérez-Tris et al.2005〕。この2属には形態的に判別が困難な種があり、遺伝子解析による分類の見直しがなされています〔Martinsen et al.2006〕。鳥マラリアは多くの種類で検出され、特にスズメ目(カナリア)、水禽類、猛禽類、ペンギン、家禽に病原性を示す可能性が高く〔Mitchell et al.2008〕、沈鬱、食欲不振、体重減少、呼吸器症状が見られます。L.caulleryiによるニワトリのロイコチトゾーン症は、養鶏に甚大な健康被害を及ぼす場合があるため、家畜伝染病予防法による届出伝染病に指定されています。他にも、Atoxoplasma属、Lankesterella属、Babesia属、Hepatozoon属などの感染例が幅広い野鳥の種類で報告されていますが、事例数は多くないです〔村田 2007〕。一般的に野鳥の血液原虫感染は不顕性と考えられていますが、一方では野鳥の散発的そして集団的な死亡例が起こっているのも事実です〔村田 2007〕。鳥類の血液原虫は主に養鶏や野鳥に多発するもので、飼鳥ではまれです。ペットの鳥では捕獲された野鳥で発見されるかもしれません。
爬虫類
爬虫類では多くの血液原虫が確認されますが、多くは有害ではありません。ドイツのペットの爬虫類報告では約29%で血液寄生虫が検出されています〔Halla et al.2014〕。もしも、発症するとしたら貧血などが考えられますが、治療に関するデータはほとんどありません。Haemoproteus属、Haemogregarina属、Hepatozoon属、Schellackia属、Sauroplasma属、Plasmodium属などが検出され、カメよりもトカゲやヘビに多く〔Halla et al.2014〕、蚊などの吸血ベクターによって感染します。
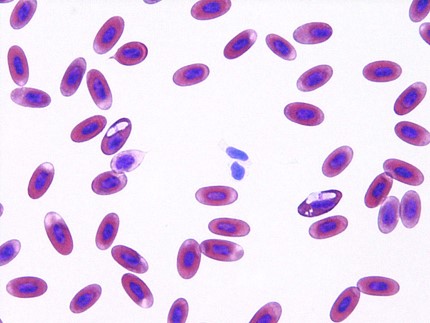
グリーンイグアナの血液原虫
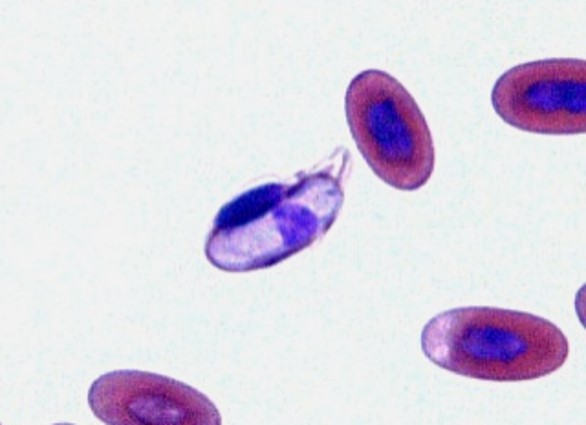
グリーンイグアナの血液原虫
カメレオンのミクロフィラリア
特にカメレオンの末梢血で発見されますが、珍しいものではありません。 ほとんどの場合、ミクロフィラリアは非病原性、爬虫類はこの寄生虫で何年も生き残ることができます。
好中球(偽好酸球)
鳥類と爬虫類の好中球は、ロマノウスキー染色をした際に、細胞質の顆粒が中性の染色反応を示さずに好酸球の顆粒に類似したピンク色~オレンジ色に染まるために、偽好酸球あるいはヘテロフィル(Heterophile)と呼ばれています。染色性の相違なだけで、哺乳類の好中球と機能的には同等で、炎症部位に浸潤し、細菌等を貪食します。
鳥類
ヘテロフィルの顆粒は桿状または紡錘状で、通常核は分葉しており、細胞質は透明~薄青色です。
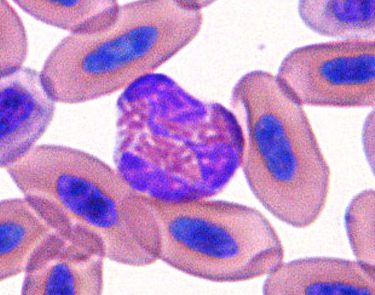
鳥類では桿状核のヘテロフィルの出現は稀で、急性炎症期に見られるかもしれません〔〕。
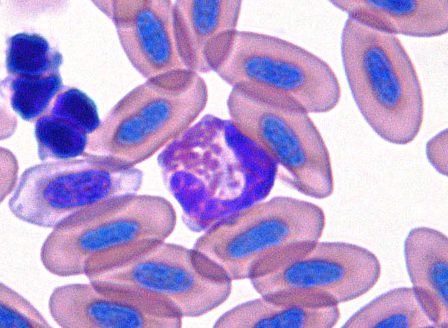
爬虫類
爬虫類でのヘテロフィルの核の形状は特異性があり、多くのカメでは円形~楕円形の偏在核をしています。細胞質は透明~薄青色です。
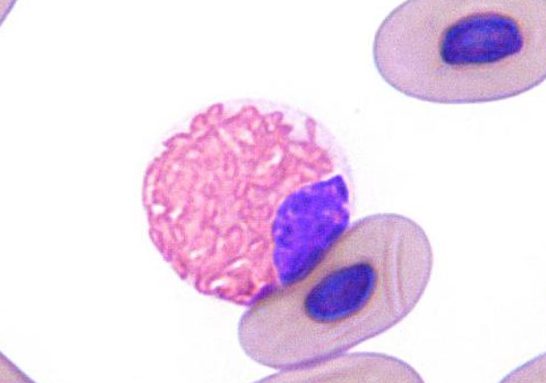
トカゲでは分葉した核をしている種類が多いです。
コラム:ヘテロフィル動物
好中球がヘテロフィルである動物は、鳥類や爬虫類以外にも、ウサギ、モルモット、アグーチ、ラット、マウスなどが有名です。他にゾウやワオキツネザルもあげられています〔Messick and Willet 1987〕。
どれが好酸球なの?
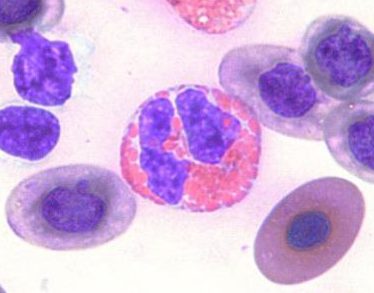
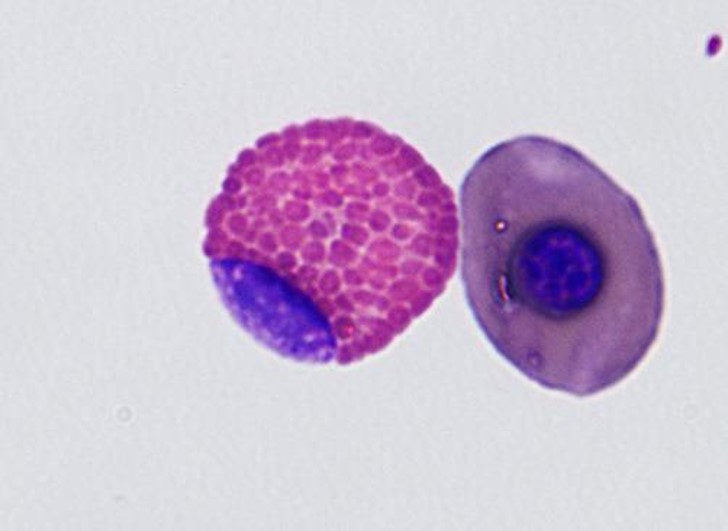
血球サイズと核の形状はヘテロフィルと同様で、顆粒も同様の色をしています。好酸球とヘテロフィルとの鑑別は、明るい色をした顆粒が丸いこと、そして顆粒が豊富で桑実状で、核まで覆い隠すことがあります。機能は完全には分かっていませんが、これらの細胞は寄生虫感染や過敏反応の反映に役割を果たす可能性がありますが、必ずしも増加するわけではありません〔Fudge 2000,Samour 2006〕。鳥類の好酸球は形態的な相違が大きく、細胞質の顆粒は小さいものから大きいものまであり、また弱い好酸性を示すものから強い好酸性を示すものもあり、一定した外貌でなく、同種間でも形態が異なります〔Fudge 2000,Samour 2006〕。ニワトリやアヒルの好酸球は、哺乳類での好酸球と同じように顆粒が結晶状ですが〔Maxwell 1986a〕、ウズラでは顆粒に脂肪滴があり、小胞体により囲まれています〔Maxwell.1986b〕。さらに爬虫類の中には、青色の顆粒をの好酸球を持つものもいます。ヘテロフィルとの鑑別を難しくします。
カメの好酸球
ヘテロと好酸球の鑑別
ヘテロフィルと好酸球の鑑別は難しいです。血液塗抹の全体を見渡すと好酸性の顆粒を持つ白血球が2種類見つかるかもしれません。顆粒が明るい色彩で丸くて大きいと好酸球で、それに比べてヘテロフィルは顆粒は小さくて粒状あるいは杆状をしています。好酸球の顆粒は、ヘテロフィルよりも均一に染色されますが、ヘテロフィルは不均一なびまん性で、個々の顆粒の認識を通常は不可能です〔Campbell et al.2010〕。しかし、好酸球は本来数が少なく、その役割りもよく分かっていないので、ヘテロフィルと一緒にカウントしても大きな誤診になりません。
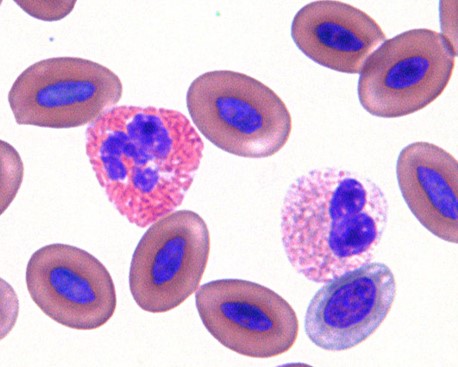
トカゲの好酸球(右)とヘテロフィル(左)
表:ヘテロフィルと好酸球の鑑別
| 血球の種類 | ヘテロフィル | 好酸球 | |
| 細胞質 | 顆粒 | 粒~桿状顆粒(不均一なびまん性) | 明るい好酸性の大型の丸い顆粒(均一に染色) |
| 細胞質色 | 透明が多い | 淡青色が多い | |
| 核 | 分葉 | 2-3 | 少ない |
| 大きさ | 好酸球よりもやや小さい | ヘテロよりやや大きい | |
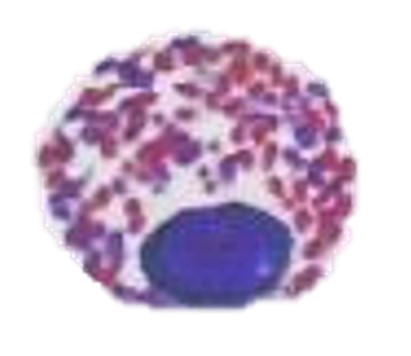
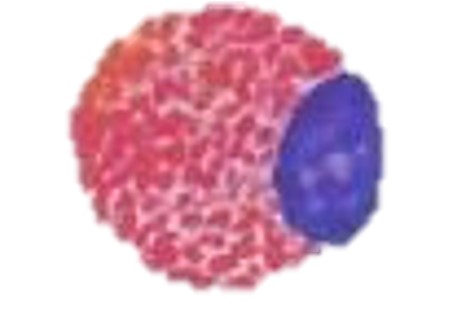
好塩基球
好塩基球は、円形から卵円形、時に2分葉した核を持ち、そして豊富な円形の紫色の顆粒が細胞質に含まれ、核を覆い隠していることが多いです。好酸球に比べて小さいです。初期の炎症反応およびおそらくアレルギー(過敏症)反応に関与しているように考えられていますが、機能は完全には分かっていません〔Fudge 2000,Samour 2006〕。爬虫類の好塩基球は、多くのカメでは円形~楕円形の偏在核をしていますが、トカゲは分葉核です。
カメの好塩基球
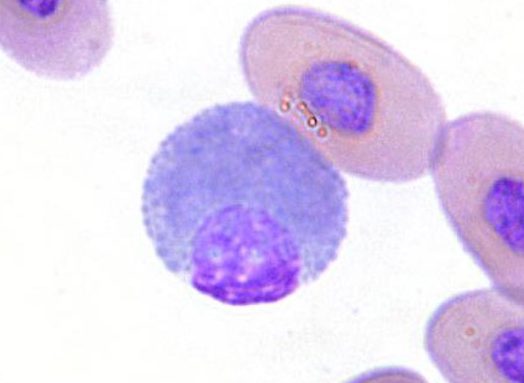
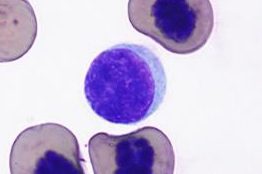
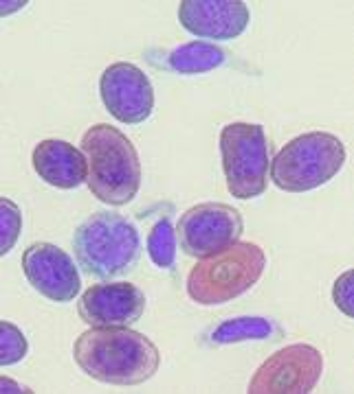
リンパ球
リンパ球の形状は哺乳類と同じで細胞は小さく、細胞質が乏しく、N/Cが高いです。核クロマチンが凝集しています。通常、鳥類の白血球はヘテロフィルが最も比率が多いのですが、ボウシインコと一部のスズメ目(カナリア)はリンパ球が主体で、循環する白血球の70%を占めることもあります〔Mitchell et al.2008,Fudge 1997〕。
カメのリンパ球
細胞質には、時折アズール顆粒が観察されます。
カメのリンパ球
小型リンパ球は爬虫類の血小板(栓球)と混同されやすいです。
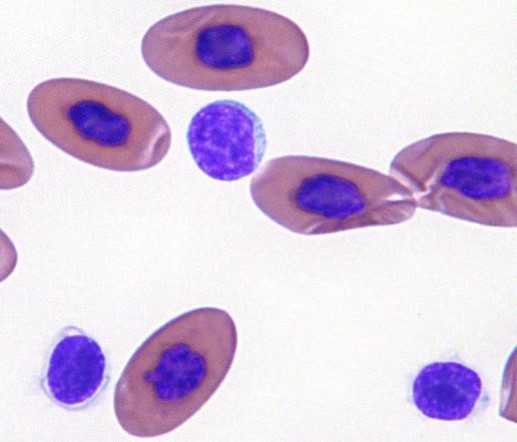
カメのリンパ球(真ん中)
リンパ球の機能も哺乳類に似ており、免疫刺激を反映しています。増加は免疫刺激と関連しており、鳥類ではウイルスの急性感染症時に見られます〔Fudge 2000,Samour 2006〕。減少は、ストレスによるヘテロフィル増多症に伴って見られることがありますが、通常これは相対的な減少であり、異常ではありません。またファブリキウス嚢に障害を与えるようなウイルス感染でも見られることがあります。
反応性リンパ球
反応性リンパ球は免疫系が感染に応答していることを示しています。反応性リンパ球の核は、正常リンパ球と同様に円形ですが、強い好塩基性の細胞質をしています〔Fudge 2000,Samour 2006〕。幼若リンパ球は通常末梢血中に見られることはありませんが、リンパ腫の場合に見られることがあります。
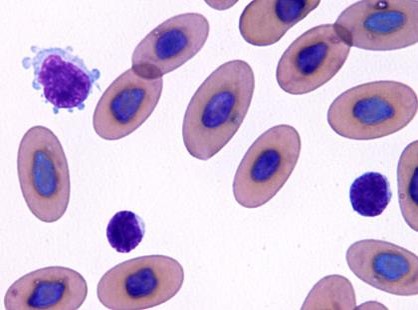
トカゲの反応性リンパ球
形質細胞
形質細胞も鳥類で見られることがあります。通常のリンパ球よりも大きく、クロマチンの凝集で偏心して配置された丸い核を持っています。 細胞質は濃い青色に染まり、核周囲のハロー(ゴルジ)が存在します。
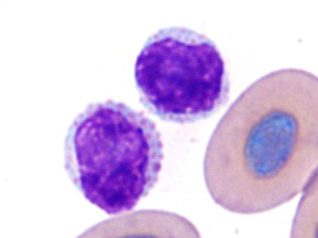
単球
円形からアメーバ状または葉状の不整な核を持つ大きな細胞で、核のクロマチンの濃縮は少なく、網状の構造で細胞質は豊富です。細胞質には空胞や好酸性の顆粒が時折見られます〔Fudge 2000,Samour 2006〕。
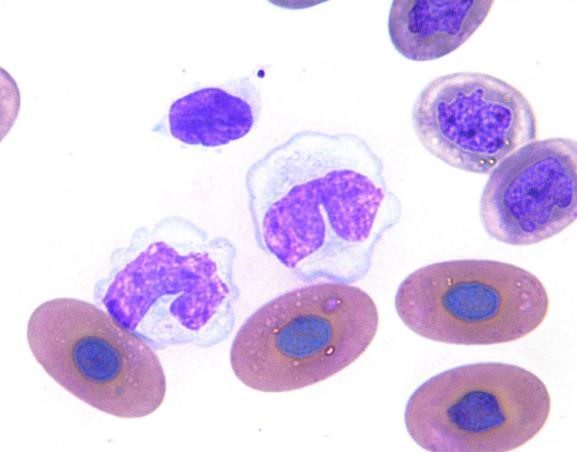
カメの単球単球は食作用能力があり、慢性炎症や腫瘍などで増加します〔Fudge 2000,Samour 2006〕。
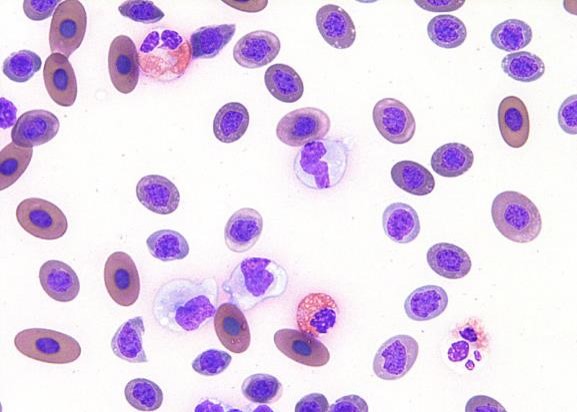
カメの単球
爬虫類のアズール球とは?
爬虫類の単球は、単球様アズール球、アズール親和性単球、またはアズール球と呼ばれることがあます。アズール顆粒とは異なり、混乱を引き起こしやすいかもしれません。アズール球とは、爬虫類で見られる貪食作用を持つ単球の仲間です。
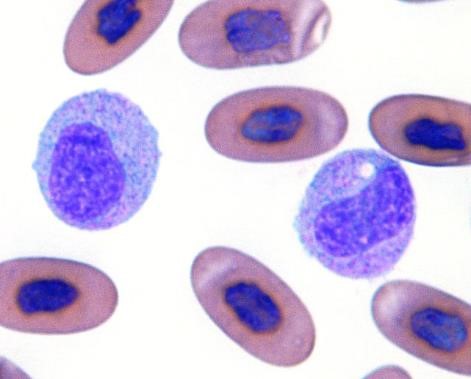
トカゲのアズール球
アズール球は単球よりもわずかに小さく、偏心して楕円形から二葉の核、好塩基性細胞質に配置され、少数の細胞質アズール顆粒を含んでいます。
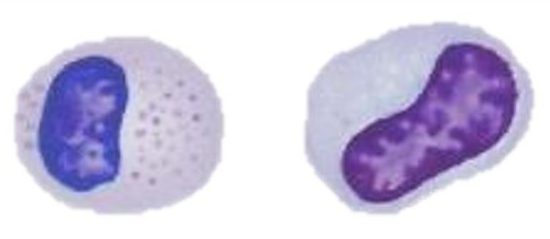
右がアズール球、左が単球
アズール球は単球とは別の血球、あるいは未成熟な単球とも言われ、爬虫類の血液学における昔からの問題でした〔Saint Girons 1970,Sypek and Borysenko1988〕。最近では、グリーンイグアナのアズール球は独立した白血球とは見なされないと言う見解もあります〔Harr et al.2001〕。また、アズール球は爬虫類の種類によって形態と機能が多少異なるとも言われ、アズール球は主にトカゲとヘビに特異的に見られます。ヘビではアズール顆粒が豊富で、どちらかと言うと好中球的な役割りをますが、トカゲでは単球的な役割りで、貪食作用が中心です〔Campbell 1996〕。
コラム:爬虫類の百分比は難しい
鳥類と爬虫類の血液検査行う検査室または人によって変動する可能性があります。特に爬虫類では、現に多数の書物や論文を見ても測定値が大きくことなります。 Wilkinson(2004)は、爬虫類において異なる2カ所の検査室において、総白血球数と単球数で大幅に異なり、場合によっては50%異なると報告し、これは検査する人によっても同様の相違が見られます〔Wilkinson 2004〕。一例として、ヨーロッパヌマガメでは、Michels(1923)が33%の好塩基球を算定しましたが、Duguy(1967)は0~4%しか報告していません。特に検査をする人々の間の、血球の鑑別の基準の相違があり、また識別は困難な血球が多いことが考えられます。上述したように 小リンパ球と栓球(血小板)、 単球とリンパ球、およびヘテロフィルと好酸球は鑑別が容易でありません〔Wilkinson 2004. Perpiñán et al.2008, Alleman et al.1992〕。 さらに、一部ではトカゲとヘビにはアズール球を報告していますが〔Wilkinson 2004,Alleman et al.1992〕、他の著者は報告していません〔Perpiñán et al.2008,Montali 1988,Harr et al.2001〕 。
感染や炎症が起こると・・・
感染症や炎症が起こると以下のような血球の変化が認められます。

白球数が増加する
主に感染による炎症性疾患時には、ヘテロフィルが増加しますが、その重症度に比例します。なお、ストレスも増加する原因になります。特に飼鳥はストレスを感じやすく、病気の時やそれによる食欲低下から来る生理的なストレスのみならず、移動や診察によるストレスによってもヘテロフィル増多が引き起こされます。よってヘテロフィル増多症が全て異常を示しているわけではないということに注意しなければなりません。
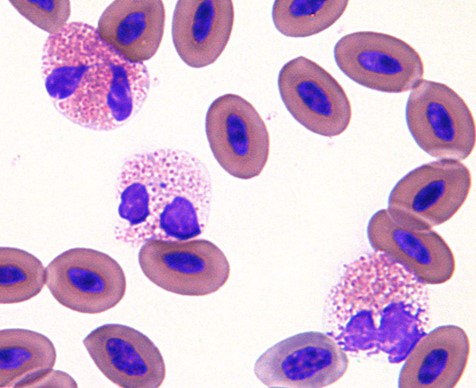
中毒性変化が見られる
中毒性変化のヘテロフィルが多く観察されます。好塩基球の細胞質、脱顆粒、膨化した顆粒、細胞質の空胞化などの所見が中毒性変化になります〔Griswold 2005,Campbell 2011,Campbell et al.2010〕。
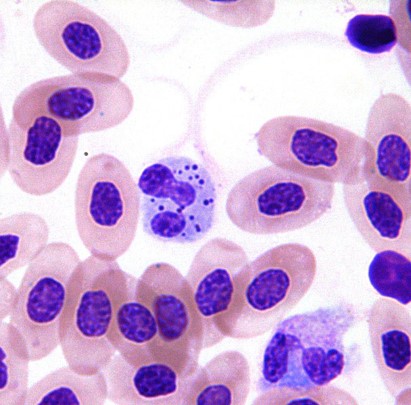
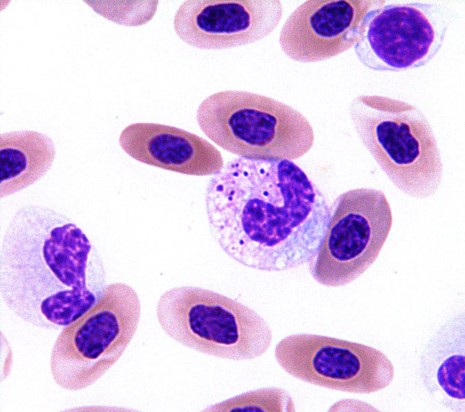
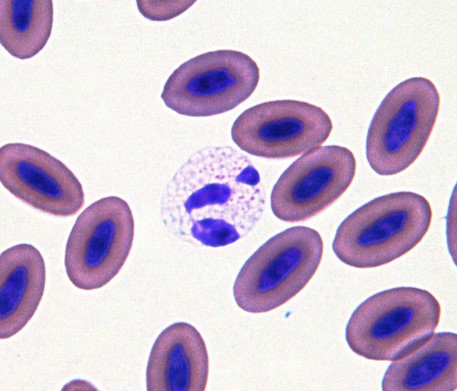
棒状核、後骨髄球および骨髄球などが多く見られる左方移動は稀です〔Griswold 2005,Campbell 2011,Campbell et al.2010〕。

インコのヘテロフィルの杆状核
反応性リンパ球の出現
スカラップ状の縁を形成することによって反応性を示します。なお、ヘビの封入体疾患(IBD)のウイルス封入体はリンパ球の細胞質で観察されます。
単球増加
単球は食作用能力を持ち、貧血や感染症に反応して白血球や赤血球を飲み込むこともよくあります。 また、敗血症になると細菌を積極的に飲み込みます。
単球/アズール球の反応
単球とアズール球の泡沫状の細胞質が誇張されて大きくなります。 細胞質の液胞および小疱形成は、反応性とともに発生します。

コラム:ストレスパターンてあるの?
コンゴウインコ、ヨウム、オウム、およびその他の鳥類で報告されており、旅行、捕獲、身体検査、運動、外傷の抑制の後に発生する可能性があります〔Campbell 1994,Fudge et al,2000〕。爬虫類でもストレスパターンがあると記載されている書物がありますが、明確には分かっていません。
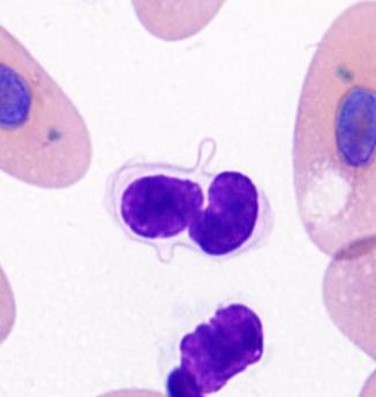
血小板(栓球)
有核細胞である血小板は、鳥類と爬虫類では栓球と呼ばれます。血液塗抹で一部凝集して観察されます。個々の栓球は形態的な相違はあるため、鑑別のために凝集塊から観察して下さい。特に爬虫類では栓球の形態が個々あるいは種類で異なります。
カメの栓球
栓球は楕円形~円形の細胞であり、赤血球よりも小さいですが、N/C比は大きいです。 細胞質は無色~灰青色で、1つまたは複数のアズール顆粒を含む場合があります 。小型リンパ球と混同しやすいので注意して下さい。核のクロマチンはリンパ球よりも均質です。
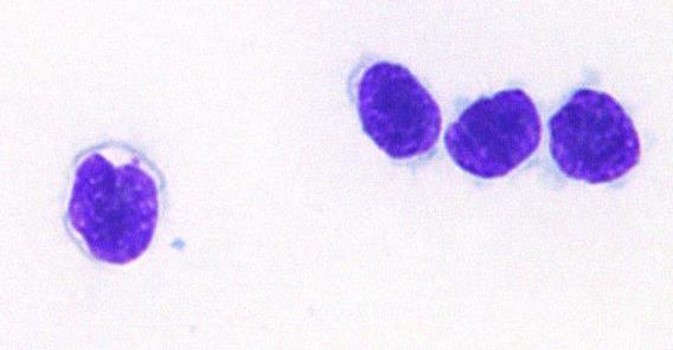
カメの栓球
主な機能は止血で、正常な栓球数は、末梢血塗抹標本の100個の白血球あたり25〜350個の血小板の範囲です。栓球の増加は過剰な利用に対する再生反応で、減少は骨髄産生の低下または過剰な末梢利用の結果起こります。
活性化栓球とは?
鳥類では栓球が止血以外に、食作用があると見なされ、血中の異物の除去を助けます〔Grecchi et al.1980〕。算出は一般的に行われていませんが、代わりに塗抹標本において、数が適切、増加、減少ているか認します。活性化された血小板は、細胞の凝集したクラスターとして現れます。大型化、好塩基性の細胞質、二核、偽足などの変化を表すと言われています。
生化学検査は何を測定する?
爬虫類の血液生化学検査の詳細な解説は少なく、鳥類ではかなり研究が進んでいます。市販ででは、鳥類/爬虫類用のスクリーニング生化学検査のセット(Vetscan®Avian/ Reptilian Profile Plus:Abaxis.Inc)がありますので、お勧めします。
このセットのスクリーニング項目には、アスパラギン酸アミノトランスフェラーゼ(AST)、胆汁酸(BA)、総タンパク質(TP)、アルブミン(ALB)、間接由来グロブリン(GLOB)、クレアチンキナーゼ(CK)、グルコース(GLU)、尿酸(UA)、カルシウム(Ca)、リン(P)、ナトリウム(Na)、カリウム(K)が1つのローターにセットされ、微量のサンプルで測定できます。

スクリーニング検査の結果に応じて、タンパク質の電気泳動、BUN(血液尿素窒素)、LDH(乳酸脱水素酵素)、CHOL(コレステロール)、TG(トリグリセリド)などを追加で検査をするべきす。
蛋白質パネル
TP
鳥類と爬虫類のTPは哺乳類よりも低く、ALBとGLOBの2つに大別され、これらの割合を調べるために電気泳動を行うこともあります。
| 上昇 | 脱水、慢性疾患、高脂血症、溶血 |
| 減少 | 飢餓ならびに栄養失調(低蛋白のエサ)、肝機能低下、腎疾患、慢性腸炎、消化管内寄生、失血 |
TPの上昇は、脱水、慢性疾患によるγグロブリン血症でみられます。また発情期のメスもTPの上昇がみられます。これは卵黄蛋白前駆物質や卵白アルブミンが肝臓で産生され、血液中に放出されるためです。高脂血症を起こすと、TPは高値を示し、正確に測定することはできなくなります。簡易的に測定するならば屈折系で測定します。

ALBは正確に測定できない
ALBを初めとする多くの血漿タンパク質は肝臓で合成され、主にTPが上昇や低下する際には、ALBの変動が考えられます。肝硬変などの肝機能低下が起こると、低ALB血症、Naおよび水分貯留を引き起こし、腹水を引き起こします。低ALB血症は、飢餓や不十分な栄養、肝機能低下、慢性腎疾患、慢性腸炎、重度の外傷による出血などが原因になります。しかし、問題となるのはALBの測定になります。通常、哺乳類のALBの測定はBCG(Bromocresol green)を使用していますが、いくつかの研究では、BCG色素結合法で得られたALB濃度は、鳥類やカメのタンパク質電気泳動で得られた濃度とは大幅に異なることが示されています。フトアゴヒゲトカゲにおいての電気泳動と、BCG色素結合測定値は常に電気泳動測定よりも高値でした〔Comolli 2021〕。そのため、一般の動物病院に設置されている生化学検査機械ではTPはビューレット法で、ALBはBCG色素結合法で測定していることから、GLOBは演算で出しています。例え爬虫類においてビューレット法でのTP測定が信用がおけると仮定したら、ALBは高めで、GLOBは低めに算出されると思われます。鳥類ではビューレット法でのTP測定も疑問視されており電気泳動が推奨されています。タンパク質電気泳動以外によるすべての爬虫類のALB測定は不正確であると見なされ、本来は回避されるべきです。しかし、正確ではないが、暫定的あるいは上昇や下降などの変動を観察する程度で、BCG色素結合法での機械測定をすることもあります。なお、Vetscan®Avian/ Reptilian Profile Plus、Abaxis.Inc)のローターでのALB測定の信頼性は分かっていません。
鳥類の主要なタンパク質はアルブミン、α1、α2、β1、β2、γグロブリン分画があり、TPは3.3~5.5mg/dLと哺乳類と比べて低い〔Fudge 1997〕。
GLOB
血漿GLOB画分は免疫グロブリンと非免疫グロブリンで構成されており、肝機能低下によりαおよびβグロブリンが減少する可能性があります。しかし、多くの免疫グロブリンは急性期タンパク質であり、炎症性疾患に対する全身性反応で肝臓での産生が増加するため、肝炎では高γグロブリン血症を引き起こす可能性があります。
タンパク質の正確な検査は電気永動
正確にALBやGLOBを測定するには電気泳動を行い、タンパク質をプレアルブミン、アルブミン、α-1および-2、βおよびγグロブリンの6つの画分に分けて評価をします。健康な鳥や爬虫類の最大の割合であるアルブミンは、炎症とともに減少します。電気泳動は、このタンパク質を正確に定量する唯一の方法です。炎症または感染により、グロブリン画分が変化します。特に、βグロブリンとγグロブリンは、A/G比の低下に反映されます。タンパク質測定は直接的な診断にはなりませんが、電気泳動は重要な予後の評価になり得ます〔Campbell et al.2007, Schmidt et al.2003〕。
腎臓パネル
爬虫類の腎臓は、老廃物の排出、水の平衡、酸塩基バランスを調節し、ホルモンとビタミンも生成しています。構造的には、糸球体、ボーマン嚢、尿細管からなるネフロンから構成され、ヘンレループを欠くのが特徴ですので、爬虫類の腎臓は高張性の尿を生成しません。膀胱(存在する場合)と総排出腔は、水と電解質の再吸収も行います〔Hpiz 2020〕。爬虫類の腎疾患の兆候は非特異的で、状態が進行するまで分かりません。犬や猫で使用される従来の検査項目とは異なるため、その測定項目の内容をしっかり理解しないといけません〔Wilkinson et al.2020〕。爬虫類の腎パネルはCa、P、K、UA、ALBがスクリーニング項目として推奨されています。 スクリーニングの結果によっては、BUN、全血球計算、タンパク質電気泳動などを行います。
Ca
| 上昇 | 脱水、高ALB血症、腫瘍娠、Ca/ビタミンD過剰のエサ、副甲状腺機能亢進症および骨溶解、脱水症、慢性疾患、産卵期 |
| 減少 | 飢餓、Ca欠乏のエサ |
Caは、主に骨や歯、甲羅の形態で体内に貯蔵され、血中のCaはPと同様に微量ですが、心筋収縮や血液の凝固などにも深く関与していす。また、鳥類も爬虫類も産卵期には身体のCaがエストロゲンの影響で動員され、高Ca血症が起こり、一方で身体のCaが不十分な状態だと低Ca血症ならびに代謝性骨疾患が起こります〔Knotek et al.2003〕。
P
| 上昇 | 溶血、成長期、食事過剰、ビタミンD過剰のエサ、腎疾患 |
| 減少 | 飢餓、ビタミンD欠乏のエサ、副甲状腺機能亢進症 |
PはCaと並ぶ骨の重要な構成成分です。血中のPは少量ですが、腎臓で調整されて一定の濃度を保っています。腎疾患があると尿への排泄量が減少して、血中のPが増加し、高P血症は腎不全のより信頼できる指標になります〔Knotek et al.2002〕。爬虫類では、特にカルシウムとの比率が重要視されます。通常、血中のCaはPの2(1.5〜4)倍ですが、腎不全になるとCa:P比が逆転します〔Griswold 2005,Campbell 2011,Campbell et al.2010〕。特にリンが通常の2倍以上の高値であると、腎臓は効果的にろ過されていない可能性があります。しかし、Pは様々な影響を受けやすく、PとKの両方の上昇は、サンプルの溶血に関連していることが多いので注意して下さい。このCa:P比はトカゲの腎臓病を特定するのに役立ちますが、カメやヘビではそれほど有用ではないと言われていますが、その真偽は分かっていません。
UA
| 上昇 | 肉食のエサ、腎疾患、痛風、敗血症 |
| 減少 | 肝機能低下 |
UAは尿酸排泄である主に陸生爬虫類の腎臓の評価になります。尿酸が高くなる腎不全になると、必然的に痛風になります。高UA血症は腎臓の損傷を示していますが、UAは腎臓が約70%の損傷までは増加しないため、比較的鈍感な検査項目です。また、UAの測定値はエサの内容が大きく影響し、肉食性爬虫類(ヘビやオオトカゲ)では草食性爬虫類よりも高値、鳥類でも肉食種は草食種のベースラインの約50%高値、またエサを摂取したばかりだと、ベースラインレベルを2~3倍の高くなることがあります。一方で、低下は慢性的な肝不全などでは尿酸自身の合成低下の可能性があります〔Hochleithner 1994〕。
BUNとUAどっちを測る?
BUNは尿素排泄である水棲~半水棲の爬虫類(水棲や半水棲のカメ)の腎臓の評価項目になります。基本的にUAと同じ解釈をします。なお、爬虫類における窒素代謝の最終産物は、アンモニア、尿素と尿酸です。水棲種ではアンモニア、半水生種や陸生種では尿素と尿酸により排泄し、尿窒素排泄の割合は、分類上の目や属内で決まったものでなく、種毎の棲息地で異なります。尿素を主要な最終排泄物としている水棲種では、食性に関わらずアンモニアと尿素がほぼ等しい割合で排泄されます〔Moyle 1949〕。

表:水棲爬虫類の窒素排泄成分の割合
| 生態 | 種類 | アンモニア(%) | 尿素(%) | 尿酸(%) |
| 水棲 | ウミガメ | 20-25 | 20-25 | 5 |
| ヌマガメ | 6-15 | 40-60 | 5 | |
| ニシキガメ | 15.3 | 39 | 18.3 |
半水棲種では尿素による排泄の割合が増し、陸生種では尿素排泄に加えて、尿酸による排泄が増えてきます〔Moyle 1949〕。

表:陸棲爬虫類の窒素排泄成分の割合
| 生態 | 種類 | アンモニア(%) | 尿素(%) | 尿酸(%) |
| 陸棲 |
モリセオレガメ | 6.1 | 61 | 4.2 |
| ギリシャリクガメ | 4.1 | 22.3 | 51.9 | |
| インドホシガメ | 6.2 | 8.3 | 56.1 | |
| サバクゴファーガメ | 3-8 | 15-50 | 20-50 |
つまり、アカミミガメなどの半水棲種はBUNを、リクガメなどの陸棲種はUAを優先して測定するべきです。しかし、種類によってはエサが少ない時など、窒素老廃物の種類を変えることがあります。ムカシトカゲはタンパク質や水分の摂取量が少ないと、尿素排泄が減少して尿酸排泄が増加し〔Hill et al.1969〕、ワニは通常はアンモニウム塩と尿酸ですが、絶食によりアンモニウム塩による排泄の割合が増します〔Coulson et al.1970〕。つまり、BUNとUAのどちらを優先して測定するのか、現在は限られたわずかな種類における知見だけで、多様な種類毎の優先項目を明確にすることは困難で、今後の研究が期待されます。分からない時には、とりあえずBUNとUAの両項目の測定をして下さい。
Kで腎不全チェック
| 上昇 | 過剰なエサ、脱水、溶血、組織損傷、腎疾患 |
| 減少 | 胃腸炎(下痢や嘔吐)、飢餓 |
Kは下述のNaやClと同じ電解質の一種です。Kには神経や筋肉の働きを調節する役割があり、低K血症になると神経が麻痺を起こします。嘔吐や下痢の影響で低くなりますが、爬虫類ではカリウム排泄の90%は腎臓を介して行われ、その機能が低下することで、Kは上昇します〔Wright 2013〕。
肝酵素パネルってどんな感じ・・・
ALT、AST、ALP、GGT、LDHは逸脱酵素と呼ばれ、細胞障害によって漏出する酵素を測定して評価します。これらの酵素は人および犬や猫のように肝臓の評価として有用であるが、鳥類でも有用と言われていますが、爬虫類では疑問視されています〔Campbell 2004〕。一般的な生化学検査の酵素測定は主に哺乳類向けに設計されており、主に37°Cで測定します。爬虫類のこれらの酵素を客観的に測定しようとした研究は少なく、肝臓特異性であるのか?肝傷害後の重症化判定できるのか?いまだ、分かっていません。またALT、AST、ALP、GGT、LDHなどは肝臓単独で評価できるものではないので、測定値を分別をもって判断する。グリーンイグアナの研究では、ALT、AST、ALP、LDHは多くの組織で見られるために、肝臓特異性とは言えず、GGTは組織活性は低く、検出できない結果でした〔Wagner 1999〕。肝障害を起こすようなことで、肝胆道酵素が上昇しますが、血漿半減期に関する情報はありませんので、予後を示すこともできません。グリーンイグアナの研究では、ALT、AST、ALP、LDHは多くの組織で見られるために、肝臓特異性とは言えず、GGTは組織活性は低く、検出できない結果でした〔Wagner 1999〕。肝障害を起こすようなことで、肝胆道酵素が上昇しますが、血漿半減期に関する情報はありませんので、予後を示すこともできません。したがって、爬虫類の肝臓の評価をする際に、鳥類に準じた項目で測定したり、あるいはこれらの項目を除外する者もいます。
ASTとLDHは有用?
ネズミヘビ(Elaphe obsoleta)の肝臓の主要な組織酵素は、ASTとLDHであったという報告もあります。しかしながら、GGTは軽微で、どの組織や血清でも検出できませんでした〔Ramsay et al.1995〕。
AST
| 上昇 | 肝炎、脂肪肝症候群、外傷、心筋炎 |
| 減少 | 加齢、肝疾患末期 |
鳥類では、ASTは主に肝臓に含まれる酵素とされ、肝機能の評価に使用されます。しかし、肝臓のみの特異性はなく、骨格筋や心筋、脳、腎臓にも含まれているため、ASTの上昇だけで肝機能を評価することはできません〔Fudge 1997〕。
LDH
鳥類では、LDHも心筋、骨格筋、肝臓、腎臓、赤血球に含まれ、肝特異的酵素ではありません。オウム科では肝疾患と連動して上昇しやすいと言われています〔Fudge 1997,Hochleithner 1994〕。
ALT
GGT
鳥類では、GGT(ガンマグルタミルトランスフェラーゼ)は哺乳類と同様に、肝臓、胆管および腎臓に含まれています。腎臓からのGGTは、大部分が尿中に排泄されるため、腎疾患で上昇することはなく、比較的肝臓・胆管疾患に特異的な酵素ですが、敏感には上昇しないと言われています〔Fudge 1998〕。
ALP
鳥類では、ALPは破骨細胞や十二指腸などに含まれ、肝臓での活性は低いと言われ、肝疾患の時の診断意義があるかどうかは不明です〔Hochleithner 1994〕。上昇は、腎性または栄養性二次性上皮小体機能亢進症で見みられ、Caの低下~正常を伴うことが多いです。その他、腸炎、発情期のメス、成長期でも上昇します。
CPKは採血の筋損傷チェック!
| 上昇 | 筋肉注射、外傷による骨格筋細胞障害、心筋症、多発性神経炎や腺胃拡張症候群等によるニューロパシィー、脳炎、ビタミンE/セレン欠乏症、鉛中毒、 |
| 減少 | 加齢、飢餓 |
鳥類と爬虫類では、CPKは骨格筋と心筋、神経などに見られ、心筋でも活性します。GOT、LDHと共に肝疾患、骨格筋・心筋疾患と鑑別に用いられます〔Wagner et al.1999〕。特に爬虫類では、採血における静脈穿刺を行う骨格筋貫通や心臓採血が原因である可能性があります。
将来に期待ビリベルジン
鳥類と爬虫類はビリベルジンレダクターゼを欠いており、胆汁汁色素酸はビリルビンでなく、ビリベルジンが主です。したがって、ビルリビンの測定は顕著な変動が見られません。しかし、現在ビリベルジンの測定は臨床的に行われておらず、検出測定に関して開発中です。臨床応用ができれば、鳥類と爬虫類の肝疾患の評価と分類に役立つ可能性があります〔Gregory et al.2002〕。もし、血中のビリベルジンレベルが上昇すると、血清や尿/尿酸が緑色~青色になります。なお、ヘビはビリベルジンをビリルビンに十分に還元できるためにビリルビンで評価できると言われています。
注目!BA!
| 上昇 | 肝機能低下 |
| 減少 | 肝不全末期 |
鳥類
爬虫類
NH3は?
NH3(アンモニア)は、タンパク質の代謝の過程で生成される毒性を持った物質です。通常、アンモニアは肝臓や腎臓を経由し、分解されて尿中に排出されます。従って、肝臓や腎臓に疾患を抱えている場合に、NH3は上昇します。しかし、NH3を測定する上で、最も重要なことはサンプルの取り扱いです。血液サンプルは冷たいヘパリン処理されたチューブに集められ、迅速に測定をしないと高値を示します。 鳥類でのアンモニアの上昇は、肝疾患時にみられ、重度の上昇は肝性脳症を引き起こします。しかし、現在では爬虫類でのアンモニアの使用に関する情報はほとんどありません。
鳥と爬虫類でこんなに違うGlu
| 上昇 | ストレス、腫瘍、膵炎 |
| 減少 | 飢餓/栄養失調、肝機能低下、全身感染症、冬眠(爬虫類) |
爬虫類
グルコースは、種や性差、環境、エサならびに栄養状態、健康状態、季節変動などによって変動します。爬虫類の血糖値は100mg/dLと哺乳類などと比べると低値です〔Campbell 199〕。人間用の糖尿病試験ストリップを使用して、全血を1滴使用して測定することもできます。冬眠などの低温環境では低値になりますが、病気の時には体重減少や削痩が見られ、無反応や立ち直り反射の喪失、震えなども起こります。肝疾患を伴う食欲抑制性爬虫類では低く、ブドウ糖が不足している補助給餌の食事の後も低いままであることがよくあります。200mg/dLを超える持続的な高血糖は爬虫類ではまれですが、原因はよく分かっていません。爬虫類の糖尿病は稀で、ストレス、代謝性疾患、腫瘍、膵炎などが可能性があります。
鳥類
鳥類のグルコースは、哺乳類よりも高く維持されています。これは飛翔という激しい運動に対し、速やかにエネルギーを供給するためです。高血糖は、糖尿病を示唆します。また来院時のストレスや短期飢餓、代謝の低下、腎腺癌のような腎疾患でも起こるため、鑑別しなければなりません。低血糖は150mg/dL以下をさし、長期飢餓、消化不良症候群で起こります。
脱水評価のNaとCl
鳥類と爬虫類の電解質または酸塩基の状態も評価されます。NaとClの増加は脱水、減少は一般に栄養失調に関連しています。カリウムの増加は腎疾患に関連している可能性があります。
Na
| 上昇 | 脱水 |
| 減少 | 栄養失調 |
Cl
| 上昇 | 脱水、腎不全 |
| 減少 | 栄養失調 |
卵を持つと上昇する項目
鳥類と爬虫類のメスは発情ならびに卵形成期に入るとCa、CHOL(コレステロール)、TG(トリグリセリド)が上昇します。繁殖期のメスのグリーンイグアナで上述した項目が上昇することが報告されています〔Knotková et al.2005〕。CHOLとTGの詳細はよく分かっていませんが、鳥類では、TCHOの上昇は、肝疾患、胆管閉塞、甲状腺機能低下症、高脂肪食、過食、時に腎疾患、低下は、低脂肪食、吸収不良症候群などでみられます。TGもTCHOと同様の変動が起こります。
膵炎指標のAMYL?
鳥類でも、AMYLは膵臓から分泌されるデンプンを加水分解する酵素です。上昇は膵炎を示唆しますが、診断には数回の検査を必要とし、またAMYLは、腎臓から速やかに排泄されるため、上昇は腎クリアランスの低下を示唆していることもあります。通常食後に上昇するため、人では必ず絶食後に測定しますが、鳥類では難しいです。よって上昇が全て異常を示すわけではありません。爬虫類ではもっとさらに良く分かっていません。
低温環境の爬虫類
低い環境温度は、爬虫類の免疫応答を抑制および阻害する可能性があります。 赤血球や白血球パラメーターの低下はもちろんですが、リンパ球数は一般的に冬の間は少なく、夏の間は多くなる季節変動があります。冬眠後の爬虫類では赤血球の大小不同症および奇形赤血増加が認められ、気温と水分補給状態の季節変化を反映しています〔Tamukai et al.2011〕。
| カロリナハコガメ | ミシシッピアカミミガメ | グリーンイグアナ | フトアゴヒゲトカゲ | ボアコンストリクター | ボールパイソン | |
| BUN(mg/dL) | 30 | 22 | 1 | 1(<1‐2) | 5(±8) | 1(±1) |
| Ca(mg/dL) | 14(±0.4) | 13.4(±3.1) | 8‐12 | 11.8(8.6‐27.2) | 15.9(±3.2) | 15.3(±2.7) |
| P(mg/dL) | 3.4(±0.1) | 5.2(±1.3) | 2.0 | 5.9(3.5‐9.8) | 4.7(±1.7) | 3.8(±1.9) |
| UA(mg/dL) | 2.0 | 1.0 | 5.0 | 5.2(1.6‐11.4) | 4.7(±2.8) | 7.6(±6.4) |
| TP(g/dL) | 4.5 | 3.6 | 4.5 | 6.6(4.5‐9.5) | 7.0(±1.3) | 6.7(±1.9) |
| Glu(mg/dL) | 36 | 70 | 155 | 210(139‐291) | 37(±14) | 23(±13) |
| ALT(IU/dL) | n/a | 14(±23) | 21 | <3(<3‐5) | 14 | 14 |
| AST(mg/dL) | 94(±43) | 183(±78) | 52 | 13(4‐40) | 35 | 55 |
| Na(mEq/L) | 130 | 121 | 157 | 153(141‐190) | 158(±7) | 159(±7) |
| K(mEq/L) | 4.7 | 4.1 | 3.5 | 3.6(1.0‐6.5) | 5.4(±1.3) | 7.1(±1.8) |
| Cl(mEq/L) | 108 | 81 | 118 | 123(80‐140) | 125(±7) | 120(±7) |
エキゾ血液カラーアトラス
意外と安いので買ってみたら?
■Alleman AR,Jacobson ER,Raskin RE.Morphologic and cytochemical characteristics of blood cells from the desert tortoise (Gopherus agassizii). Am. J. Vet.Res. 53:1645-1651.1992
■Altland PD,Brace KC.Red cell life span in the turtle and toad.American Journal of Physiology203:1188.1962
■Barrows M,McArthur S,Wilkinson R.Diagnosis. in Medicine and Surgery of Tortoises and Turtles.McArthur S,Wilkinson R,Meyer J.eds:132–140.Blackwell.Ames.IA.2004
■Benson KG.Effects of hemolysis on plasma electrolyte and chemistry values in the common green iguana (Iguana iguana).Journal of Zoo and Wildlife Medicine30(3):413-415.2014
■Battison AL,Buckzowski S,Archer FJ.Plasma bile acid concentration in the cockatiel. Can Vet J 37:233-234.1996
■Chasis JA,Mohandas N.Blood112:470‒478.2008
■Campbell TW,Ellis CK.Hematology of reptiles.In Avian and Exotic Animal Hematology and Cytology. 3rd ed.Campbell TW,Ellis CK eds.Blackwell Publishing.Ames.IA.:51-81.2007
■Campbell TW.Hematology.In Avian medicine: principles and applications.Ritchie BW,Harrison GJ,Harrison LR eds.Wingers Publishing.Lake Worth.FL:p176-98.1994
■Campbell TW.Clinical Pathology.In Reptile Medicine and Surgery.Mader DR ed.WB Saunders.1996
■Campbell TW.Clinical pathology.In Current Therapy in Reptile Medicine and Surgery.1st ed.Mader DR,Divers SJeds.Elsevier Saunders.St Louis,MO:70-92.2014
■Campbell TW.Clinical Chemistry of Reptiles.In Veterinary hematology and clinical chemistry.Thrall MA ed.Baltimore,Lippincott Williams and Wilkins:493-498.2004
■Cambell TW.Comparative clinical chemistries in exotic animal medicine.Paper presented at:Western Veterinary Conference;February 23.Las Vegas, NV.2011
■Campbell TW,Grant K.Herptile hematology case studies.In Clinical Cases in Avian and Exotic Animal Hematology and Cytology.1st ed.Campbell TW, Grant K,ed.Wiley-Blackwell Publishing.Ames,IA:95-121.2010
■Comolli JR.Comparison of Protein electrophoresis and biochemical analysis for the quantification of plasma albumin in healthy Bearded dragons(Pogona vitticeps).Journal of Zoo and Wildlife Medicine 52(1).2021
■Campbell TW.Hematology of psittacines. In Schlm’s veterinary hematology.6th ed.Weiss DJ,Wardrop KJ,eds.Wiley-Blackwell.Hoboken NJ:p968‐76.2010
■Campbell TW,Ellis CK.Hematology of birds.In Avian and exotic animal hematology and cytology.3rd ed.Campbell TW,Ellis CK eds.Blackwell Publishing Professional.Ames IA:p3‐50.2007
■Campbell TW, Dein FJ. Avian hematology. The basics.Vet Clin North Am Small Anim Pract14(2):223‐248.1984
■Clark P, Boardman WSJ,Raidal SR. General hematological characteristics of birds. In: Atlas of clinical avian hematology. Ames (IA): Wiley-Blackwell:p33‐53.2009
■Coulson RA,Hemandez T.Nitrogen metabolism and excretion in the living reptile.In Comparative Biochemistry of Nitrogen Metabolism2.Campbell JW ed.The Verteblates. Academic Press, New York:p640-710.1970
■Capitelli R, Crosta L. Overview of psittacine blood analysis and comparative retrospective study of clinical diagnosis, hematology and blood chemistry in selected psittacine species. Vet Clin North Am Exot Anim Pract16:71‐120.2013
■Carisch L et al.White blood cell count in birds: evaluation of a commercially available method.BMC Vet Res15:93.2019
■Dein FJ,Wilson A,Fischer D,Langenberg P.Avian leucocyte counting using the hemocytometer.J Zoo Wildl Med25(3):432–437.1994
■Doneley B.Interpreting diagnostic tests.In Avian medicine and surgery in practice:companion and aviary birds. London:Manson Publishing Ltd:p69–91.2011
■Duguy R.Le cycle annuel des éléments figurés du sang chez Emys orbicularis L.,Lacerta muralis Laur.et Natrix maura L.Bull Soc Zool Fr. 92:23-37.1967
■Fair J,Whitaker S,Pearson B.Sources of variation in haematocrit in birds.Ibis149:535–552.2007
■Fudge AM.Avian clinical pathology—hematology and chemistry. In: Altman RB,Clubb SL, Dorrestein GM, et al,eds.Avian medicine and surgery.WB Saunders Philadelphia:p142‐57.1997
■Fudge AM,Joseph V.Disorders of avian leukocytes. In: Fudge AM, editor. Laboratory medicine: avian and exotic pets.WB Saunders Co.Philadelphia:p19–25.2000
■Fudge AM.Avian complete blood count.In Laboratory medicine: avian and exotic pets.Fudge AM ed.WB Saunders Co.Philadelphia:p9–18.2000
■Freidlin PJ.Destructive effect of heparin on avian erythrocytes.Avian Pathol14(4):531-536.1985
■Fudge AM.Avian hematology‐identification and interpretation.In proc Assoc Avian Vet.Seattle.WA.p284-292.1989
■Glick B.Normal growth of the bursa of Fabricius in chicken.Poultry Sci35:224-225.1956
■Gilles-Baillien M.Seasonal variations in weight and hematological data of Testudo hermanni hermanni Gmelin.Archives Internationales de Physiologie et de Biochimie81(4):723-732.1973
■Griswold WG.Basic reptilian clinical pathology.Paper presented at:Western Veterinary Conference;February 20.Las Vegas.NV.2005
■Gregory CR,Latimer KS,Ritchie BW.Development of a biliverdin detection assay in birds.Proc AAV:17-18.2002
■Gott denker NL,Jacobson ER.Effect of venipuncture sites on hematologic and clinical biochemical values in desert tortoises (Gopherus agassizii).Am J Vet Res56:19–21.1995
■Grecchi R,Saliba AM,Mariano M.Morphological changes,surface receptors and phagocytic potential of fowl mononuclear phagocytes and thrombocytes in vivo and in vitro.J Pathol130:23–31.1980
■Glomski CA,Pica A.The Avian Erythrocyte:Its Phylogenetic Odyssey.Boca Raton FL:CRC Press.2011
■Hawkey CM,Bennett PM,Gascoyne SC,Hart MG,Kirkwood JK.Erythrocyte size, number and haemoglobin content in vertebrates.Br J Haematol77:392–397.1991
■Heard DJ,Harr KE,Wellehan JFX.Diagnostic sampling and laboratory tests.in BSAVA Manual of Reptiles.Girling SJ,Raiti P.eds.BSAVA,Gloucester,UK.p71–86.2004
■Heatley JJ.Evaluating reptile and amphibian hematology:a clinical perspective. In: Proceedings from the Association of Avian Veterinarians Annual Conference.New Orleans,LA.39‐46.2014
■Harr K,Romagnano A.Avian cytology.In Proceedings from the Association of Avian Veterinarians Annual Conference:137–146.Jacksonville, FL.2013
■Harr KE.Diagnostic value of biochemistry.In Clinical avian medicine volII.Harrison EJ,Lightfoot TL eds.p611–629.Spix Publishing.Palm BeachFL.2006
■Halla U et al.Blood parasites in reptiles imported to Germany.Parasitol Res113(12):4587-4599.2014
■Hill L,Dawbin WH.Nitrogen excretion in the tuatara Spenodon punctatus.Comp Biochem Physiol31:453-468.1969
■Herbert R,Nanney J,Spano JS et al.Erythrocyte distribution in ducks.Am J Vet Res50:958‐960.1989
■Hochleithner M.Biochemistries.In Ritchie BW,Harrison GJ,Harrison LR.Avian Medicine.Principles and Application. Wingers Publishing.Florida.p223‐245.1994
■Hoefer HL.Bile Acid Testing in Psittacine Birds.In Seminars in Avian & Exotic Pet Medicine2.Fudge AM.ed:14-24.1994
■Hpiz PH.Anatomy and Physiology of the Reptile Renal System.Vet Clin North Am Exot Anim Pract23(1):103-114.2020
■Harr KE,Alleman AR,Dennis PM,Maxwell LK,Lock BA,Bennet RA,JAcobson ER Morphologic and cytochemical characteristics of blood cells and hematologic and plasma biochemical reference in green iguanas.J Amer Vet Med Assoc218:915-921.2001
■John JL.The avian spleen:a neglected organ.Q Rev Biol69:327–351.1994
■Jones MP,Arheart KL,Cray C.Reference intervals, longitudinal analyses,and index of individuality of commonly measured laboratory variables in captive bald eagles(Haliaeetus leucocephalus).J Avian Med Surg28:118–26.2014
■Joseph V.Reptile Clinical Pathology.ExoticsCon 2015 Pre-conference Proceedings:p155‐162.2015
■Kobayashi I,Sugawara K,Goto T,Asanuma K,Yamashita J,Ubukawa K,Guo YM,Takahashi N,Wakui H,Sawada K,Nunomura W.Regulation of ATP production during terminal differentiation of human erythropoiesis.12th International Congress of Cell Biology (ICCB), Prague Congress Centre, Czech Republic, P319 (Program & Abstract Book, p286).2016
■Knotkova Z,Dorrestein GM,Jekl V,et al.Fasting and postprandial serum bile acid concentrations in 10 healthy female red-eared terrapins (Trachemys scripta elegans).Veterinary Record163:510-514.2008
■Knotek Z,Hauptman K,Knotková Z,Hájková P,Tichý F.Haemogram and Plasma Biochemistry in Green Iguanas with Renal Disease.Acta Veterinaria Brno71:333-340.2002
■Knotek Z,Knotková Z,Doubek J,Pejřilová S,Hauptman K Plasma Biochemistry in Female Green Iguanas (Iguana iguana) with Calcium Metabolism Disorders.Acta Veterinaria Brno72:183-189.2003
■Knotková Z,Pejřilová S,Trnková Š,Matoušková O,Knotek Z. Influence of Reproductive Season upon Plasma Biochemistry Values in Green Iguanas. Acta Veterinaria Brno74:515-520.2005
■Lopez-Olvera JR.Effect of venipuncture site on hematologic and serum biochemical parameters in marginated tortoise.Testudo marginata.J.Wildlife Dis39:830–836.2003
■Martinsen ES,Paperna I,Schall JJ.Morphological versus molecular identification of avian Haemosporidia:an exploration of three species concepts.Parasitology133:279‐288.2006
■McBride MP et al.Preliminary evaluation of pre- and post-prandial 3α-hydroxy-bile-acids in the green iguana ( Iguana iguana).Journal of Herpetological Medicine and Surgery 16(4).2006
■McBride M,Hernandez-Divers SJ,Koch T,et al. Preliminary evaluation of pre- and postprandial 3α-hydroxy-bile-acids in the green iguana (Iguana iguana). Journal of Herpetologic Medicine and Surgery16:129-134.2007
■Messick JB,Willet E.Kurloff-like bodies in peripheral blood mononuclear cells from a capybara.Veterinary Clinical Pathology16(4):88-89.1987
■Montesinos A,Martínez R,Jimenéz A.Plasma Bile Acids Concentration in Tortoises:Reference Values and Histopathologic Findings of Importance for Interpretation. Proc.27th WSAVA/FECAVA/AVEPA Congress,Granada,Spain,3-6.volumeII125-126.2002
■Montali RJ.Comparative pathology of inflammation in the higher vertebrates(Reptiles, Birds and Mammals).J Comp Pathol99:1-26.1988
■Michels NA.The mast cell in lower vertebrates. La Cellule 33:337-462.1923
■Mitchell EB,Johns J.Avian hematology and related disorders. Vet Clin North Am Exot Anim Pract11:501–522.2008
■Maxwell M.Fine structural and cytochemical studies of eosinophils from fowls and ducks with eosinophilia.Res Vet Sci41(2):135-48.1986
■Moyle V.Nitrogenous excretion in chelonian reptiles.Biochem J44,581-584.1949
■Maxwell MF.Ultrastructural and cytochemical studies in normal Japanese quail (Coturnix coturnix japonica) eosinophils and in those from birds with experimentally induced eosinophilia.Res Vet Sci41(2):149-61.1986b
■Mckibben JS,Harrison GJ.Clinical anatomy.In Clinical avian medicine and surgery.Harrison GJ,Harrison LR eds.WB Sauders Company.Philadelphia:p31-66.1986
■Murray, M.J. Reptilian blood sampling and artifact considerations.In Laboratory Medicine:Avian and Exotic Pets.Fudge AM ed.W.B.Saunders,Philadelphia.p185–192.2000
■Natt MP,Herrick CA.A new blood diluent for counting the erythrocytes and leucocytes of the chicken.Poult Sci31(4):735-738.1952
■Nardinin G,Leopardi S,Bielli M.Clinical hematology in reptilian species.Vet Clin Exot Anim16:1-30.2013
■Oyewale JO,Durotoye LA.Osmotic fragility of erythrocytes of two breeds of domestic fowl in the warm humid tropics.Lab Anim22(3):250‐254.1988
■Perpiñán DSM, Hernandez-Divers D,McBride M et al.Comparison of three different techniques to produce blood smears from green iguanas, Iguana iguana.J.Herpetol. Med.Surg16:99-101.2006
■Perpiñán D,Hernandez-Divers SM,Latimer KS et al.Hematology of the Pascagoula map turtle (Graptemys gibbonsi) and the south-east Asian box turtle (Cuora amboinensis).J.Zoo Wildl. Med39:460-463.2008
■Pérez-Tris J,Hasselquist D,Hellgren O,Krizanauskiene A,Waldenström J,Bensch S.What are malaria parasites ?Trends in Parasitology21:209-211.2005
■Pejřilová S,Knotková Z,Knotek Z,Vrbas J Age-Related Changes of the Haematological Profile in Green Iguana(Iguana iguana rhinolopha).Acta Vet Brno73:305-312.2004
■Ramsay EC,Dotson TK.Tissue and serum enzyme activities in the yellow rat snake (Elaphe obsoleta quadrivitatta).Am J Vet Res56:423-8.1995
■Romagnano A.Avian clinical pathology.In Proceedings from the British Small Animal Veterinary Association Annual Conference:344–347. Birmingham,UK.2014
■Saint Girons MC Morphology of the circulating blood cells.In Biology of the Reptilia vol3(Morphology C).Gans C,Parsons TS eds.Academic Press.London:73-91.1970
■Samour J.Diagnostic value of hematology.In Clinical Avian.Medicine2.Harrison GJ,Lightfoot TLeds.Spix.Palm Beach.FL:587-609.2006
■Scanes CG.Allometric and phylogenic comparisons of hematological parameters between and within birds and mammals.Int J Vet Heal Sci Res4:123–129.2016
■Snyder GK,Sheafor BA. Red blood cells:centerpiece in the evolution of the vertebrate circulatory system.Am Zool39:189–198.1999
■Storz JF.Hemoglobin–oxygen affinity in high-altitude vertebrates: is there evidence for an adaptive trend? J.Exp.Biol219:3190–3203.2016
■Stahl SJ. REPTILE HEMATOLOGY AND SERUM CHEMISTRY.The North American Veterinary Conference2006:1673-1676.2006
■Schaffner F.The Liver.In Biology of the Reptilia.Vol19(Morphology G).Gans C,Gaunt AS eds.Society for Study Amphibians and Reptiles.Ithaca, New York:513-514.1998
■Svensmark H.Astron. Geophys48, 1.18‒1.24.2007
■Sypek J,Borysenko M Reptiles.In Vertebrate blood cells.Rowley AF,Ratcliffe NA eds.Cambridge Univ Press.Cambridge:211-25.1988
■Samour J.Diagnostic value of hematology.In Clinical Avian Medicine.Vol2.Harrison GJ,Lightfoot TL eds.Spix.Palm Beach.FL:587-609.2006
■Terry W.Campbell, Christine K.Ellis著.鳥類とエキゾチックアニマルの血液学、細胞診.斑目広郎訳.文永堂出版.東京.2010
■Tamukai k et al.Plasma biochemical reference values in clinically healthy captive bearded dragons(Pogona vitticeps)and the effects of sex and season.Veterinary Clinical Pathology40(3).2011
■Ward PD.Out of Thin air, Joseph Henry Press,USA.2006
■Walberg J.White blood cell counting techniques in birds.In Semin in Avian Exot Pet Med.Elsevier:72–76.2001
■Wilkinson SL,Divers SJ.Clinical Management of Reptile Renal Disease.Vet Clin North Am Exot Anim Pract23(1):151-168.2020
■Wilkinson R.Clinical pathology.In Medicine and Surgery of Tortoises and Turtles.McArthur S,Wilkinson R,Meyer J eds.Blackwell Publishing.Oxford, UK:p141-186.2004
■Woerpel RW,Clinical experience with avian laboratory diagnostics.Vet Clin North Am Small Anim Pract14(2):249‐286.1984
■Wright K.Diaganosing and managing renal disease in reptules.2013 Proceedings Association of Reptilian and Amphibian Veterinarians.p127‐132.2013
■Wagner RA.Tissue and plasma enzyme activities in juvenile green iguanas.Division of Laboratory Animal Resources, University of Pittsburgh.PA 15261, USA.Am J Vet Res60(2):201-203.199
■Zaias J.et al.Biochemical and hematologi values for 18 clinically healthy radiated tortoises Geochelone radiata on St Catherines Island,Georgia.Vet Clin Pathol35:321–325.2006
■越田豊、常木和日子 共著.光学顕微鏡でみる比較動物学.培風館.1994
■村田浩一.野生鳥類における血液原虫症研究の現状と課題―ニホンライチョウのロイコチトゾーン感染に関する研究を例に―.全国環境研会誌32(4):14‐19.2007
■クンケール・カセム、小島直子、杉山大介.動物種間における赤血球造血の多様性.血液フロンティア24(4):541-548.2014